Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
Фактором, вызывающим коагуляцию, может быть любое внешнее воздействие, нарушающее агрегативную устойчивость системы. Кроме изменения температуры в его роли может выступать механическое воздействие (интенсивное встряхивание, перемешивание, перекачивание по трубам), действие света и различного рода других излучений, действие электрических разрядов. Однако наиболее эффективным способом является добавление в золь электролитов. Они быстро и резко влияют на толщину ДЭС и величину ζ-потенциала частицы.
Многочисленные исследования показали, что добавление в золь практически любого электролита вызывает уменьшение его устойчивости. Однако с заметной скоростью коагуляция золя будет происходить, если концентрация добавляемого электролита в растворе достигает строго определенной величины.
Та минимальная концентрация электролита в коллоидном растворе, которая вызывает протекание в нем явной коагуляции, называется порогом коагуляции данного электролита. Она измеряется в ммоль/дм3 или в моль/м3 и обозначается СП или γ.
Величину, обратную порогу коагуляции, называют коагулирующей способностью и обозначают VK: VK = 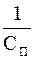 .
.
Порог коагуляции обычно определяют визуально и опытным путем, поэтому его величина может зависеть от ряда субъективных факторов. Например, от момента его фиксирования после внесения электролита, от метода наблюдения, от концентрации исследуемого золя и др. Поэтому все это необходимо учитывать, особенно если проводится сравнительный анализ воздействия одного и того же электролита на разные золи или разных электролитов на один и тот же золь.
Опытным путем было установлено, что коагулирующее воздействие на коллоидный раствор оказывает не весь электролит, а только те его ионы, знак заряда которых противоположен заряду гранулы (или совпадает со знаком заряда противоионов мицеллы).
Так коагуляцию золя с отрицательно заряженными гранулами вызывают катионы электролита, а золя с положительно заряженными гранулами – его анионы.
Очень часто порог коагуляции и коагулирующую способность определяют не по концентрации всего электролита в растворе, а только его коагулирующего иона.
В 1882 г. Г. Шульц, а несколько позже и М. Гарди показали, что коагулирующая способность ионов электролита напрямую зависит от величины их заряда. Причем с увеличением величины заряда иона на единицу его коагулирующая способность возрастает в 10 и более раз. Эта закономерность получила название правило Шульца-Гарди и носит приближенный характер. Это связано с тем, что кроме величины заряда на коагулирующую способность иона оказывает влияние и ряд других факторов: природа иона, его радиус и способность к сольватации (гидратации для водных растворов).
У ионов с одинаковой величиной заряда коагулирующая способность возрастает с увеличением их радиуса и уменьшением степени сольватации. По данному признаку ионы располагают в так называемые лиотропные ряды Гофмейстера:
Li+, Na+, K+, Rb+, Cs+;
Mg2+, Ca2+, Sr2+, Ba2+;
F–, Cl–, Br–, I–
увеличение коагулирующей способности ионов электролита
Таким образом, коагулирующая способность ионов электролита в растворе напрямую связана с их способностью к адсорбции на твердой поверхности.
В зависимости от механизма действия различают 2 вида коагуляции золей электролита: концентрационную и нейтрализационную.
Концентрационная коагуляция наблюдается при увеличении содержания в золе электролита, не вступающего в химическое взаимодействие с компонентами двойного электрического слоя мицеллы. Такие электролиты называются индифферентными. Их ионы не способны достраивать кристаллическую решетку агрегата и не могут реагировать с потенциалопределяющими ионами, образуя нерастворимые соединения. При увеличении концентрации такого электролита в растворе диффузный слой мицеллы сжимается из-за перехода ее противоионов и коагулирующих ионов электролита в адсорбционный слой. Одновременно с этим процессом уменьшается и электрокинетический потенциал гранулы (но не поверхностный потенциал).
Наблюдения показали, что для большинства коллоидных систем явная коагуляция наступает, если значение ζ-потенциала достигает одного и того же критического значения: ≈ 0,029-0,03 В.
В идеале при добавлении электролита ζ-потенциал гранулы может уменьшаться до нуля. Такое состояние коллоидной системы называется изоэлектрическим. В этом случае у коллоидных частиц отсутствует и диффузный слой. Такие системы являются максимально неустойчивыми.
При нейтрализационной коагуляции ионы прибавляемого электролита способны взаимодействовать с потенциалопределяющими ионами агрегата, образуя на его поверхности нерастворимые соединения. В этом случае наряду с ζ-потенциалом уменьшается и общий (поверхностный или электротермодинамический) потенциал частицы.
Если электролит в коллоидный раствор вводят не сразу, а небольшими порциями через определенные промежутки времени, может наблюдаться явление привыкания. Привыканием называется повышение устойчивости золя к коагулирующему действию электролита в случае уменьшения скорости его поступления. Этот факт учитывают в медицине при внутривенных инъекциях больших объемов растворов лекарственных веществ.
При смешивании двух устойчивых коллоидных растворов с разноименно заряженными гранулами нередко происходит образование осадка, называемое взаимной коагуляцией золей.
Дата добавления: 2020-07-18; просмотров: 1233;











