Водные растворы электролитов
Вода является растворителем для многих веществ. Это обусловлено полярным характером молекул воды и способностью ее молекул образовывать химические связи с другими молекулами.
В растворах слабых электролитов процесс диссоциации протекает обратимо, и к нему может быть применен закон действующих масс. Так, для процесса диссоциации кислоты
 НА Н+ + А-
НА Н+ + А-
константа равновесия КС равна
КС = [Н+]×[А-] / [НА].
Для процесса диссоциации слабого основания

 ROH R+ + OH-
ROH R+ + OH-
константа равновесия равна
КД = [R+][OH-] / [ROH].
Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, а также от температуры и не зависит от концентрации раствора.
Константа диссоциации указывает на прочность молекул в данном растворе. Чем меньше константа диссоциации в данном растворе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы.
Степень диссоциации «а» изменяется с концентрацией раствора.
Оствальдом был установлен закон разбавления
КД = 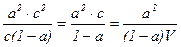 , V = 1/с, (3.24а)
, V = 1/с, (3.24а)
если а << 1, то КД = а2с и а = 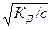 . (3.24б)
. (3.24б)
Из уравнения (3.24б) следует, что степень диссоциации уменьшается с увеличением концентрации слабого электролита.
Многие свойства растворов, такие, как осмотическое давление, температура кипения и замерзания, давление насыщенного пара, зависят как от концентрации раствора, т. е. от числа растворенных в нем частиц, так и от взаимного влияния этих частиц друг на друга.
В растворах слабых электролитов взаимодействие ионов друг с другом относительно невелико вследствие их незначительной концентрации.
Сильные электролиты в растворах диссоциированы практически полностью и концентрация ионов в них велика, поэтому свойства таких растворов существенно зависят от степени взаимодействия входящих в их состав ионов как с друг другом, так и с полярными молекулами растворителя.
С ростом концентрации электролита более сильное влияние на свойства раствора начинает оказывать процесс образования гидратов. В результате процесса гидратации изменяются размеры растворенных частиц, плотность их заряда, а также вязкость всего раствора в целом.
При увеличении концентрации раствора электролита более важную роль во взаимодействии между растворенными частицами начинают играть быстродействующие силы химической связи. Природа и энергия этих сил зависят от специфических свойств взаимодействующих частиц, поэтому с ростом концентрации увеличивается различие в свойствах растворов электролитов одинаковой концентрации, но разного химического состава.
Вычисление коэффициента активности по экспериментальным данным позволяет определить значения средних коэффициентов активности электролита. Так для электролита АnBm
g+- = 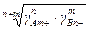 . (3.25)
. (3.25)
Коэффициенты активности зависят от природы растворителя и растворенного вещества, от концентрации раствора, а также от температуры и меняются в очень широких пределах: в области разбавленных растворов они стремятся к единице, в области высококонцентрированных растворов они достигают десятков и сотен единиц.
Коэффициенты активности сами по себе не раскрывают природы процессов, протекающих в реальных системах, но они позволяют, используя математические соотношения, быстро и легко рассчитать свойства растворов.
Дата добавления: 2021-11-16; просмотров: 564;











