Влияние pH на растворимость электролитов
По существу, влияние pH на растворимость – это частный случай влияния добавок на растворимость малорастворимого электролита. Однако, при этом возможны варианты как аналогичные рассмотренным выше, так и отличающиеся от них.
Например, влияние концентрации гидроксид-ионов на растворимость гидроксида магния, очевидно, аналогично рассмотренному выше влиянию концентрации сульфид-ионов на растворимость сульфида цинка:
Пример 5
Рассчитать растворимость гидроксида магния при pH = 11.
Решение:
а) напишем уравнение равновесия и соответствующее ему выражение ПР:Mg(OH)2¯ «Mg2+ + 2OH–, ПР = [Mg2+]× [OH–]2 = 6×10–10.
б) определим [OH–] при pH = 10: [OH–] = 1×10–4 моль/л.
в) рассчитаем [Mg2+] = ПР/[OH–]2 = 6×10–10/(1×10–4)2 = 6×10–2 моль/л.
Очевидно, такой же будет растворимость гидроксида магния.
Пример 6
Рассчитать концентрацию гидроксида натрия, которая потребуется для уменьшения растворимости гидроксида магния в 10 разпо сравнению с растворимостью его в воде.
Решение:
Напишем уравнение для равновесия в насыщенном растворе гидроксида магнияи соответствующее выражение Пр:
Mg(OH)2¯ «Mg2+ + 2OH–, ПР = [Mg2+]× [OH–]2 = 6×10–10.
Расчет растворимости этого электролита в воде (обозначим ее Р1) показан в примере (2): Р1= [Mg2+]1= 1/2 ×[OH–]1= 5,3×10–4 моль/л.
Растворимость, заданная условием (обозначим ее Р2), должна быть в 10 раз меньше, т.е. 5,3×10–5 моль/л.
В присутствии избытка щелочи показателем растворимости гидроксида магния может быть концентрация только ионов магния, т.е.
Р2 = [Mg2+]2= = ПР/[OH–]2, моль/л.
Тогда [OH–] = ÖПР/S2 = Ö6×10-10/5,3×10–5 = 3,4×10–3 моль/л. Очевидно, такой же должна быть и концентрация щелочи для обеспечения заданной растворимости, т.е. с(NaOH) = 3,4×10–3 моль/л.
Пример 7. Как влияет концентрация ионов водорода на растворимость фосфата цинка?
Решение:
Напишем уравнение равновесия для насыщенного раствора этой соли и соответствующее ему выражение ПР:
Zn3(PO4)2¯ 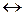 3Zn2+ + 2PO43– ПР = [Zn2+]3× [PO43–]2.
3Zn2+ + 2PO43– ПР = [Zn2+]3× [PO43–]2.
На первый взгляд ионы водорода в равновесии не участвуют, и поэтому не должны влиять на растворимость этой соли. Однако, в равновесии участвуют анионы слабой кислоты, фосфат-ионы, которые могут связываться с ионами водорода, образуя гидро-, дигидрофосфат- ионы и молекулы фосфорной кислоты. В любом из этих вариантов концентрация ионов PO43– в растворе будет уменьшаться, что в соответствии с принципом Ле Шателье приведет к смещению равновесия вправо, т.е. к увеличению растворимости осадка.
Количественная оценка влияния pH на растворимость электролитов рассмотрена в разделе «Ионно-молекулярные реакции», где показано, что для одних электролитов растворимость существенно зависит от pH раствора, а для других этим фактором можно практически пренебречь.
Влияние комплексообразования на растворимость малорастворимых электролитов.
Анализ влияния комплексообразования на равновесие растворимости малорастворимого электролита качественно аналогичен рассмотренному выше влиянию pH на растворимость солей слабых кислот, с той лишь разницей, что при образовании комплексов чаще связываются не анионы, а катионымалорастворимого электролита.
Типичными комплексообразователями (cм. тему «Комплексные соединения») являются катионы металлов побочных подгрупп (меди, цинка, хрома и т.д.), поэтому чаще для их солей или оснований приходится рассматривать комплексообразование как один из вариантов увеличения растворимости. В щелочных растворах в число комплексообразователей попадают также катионы амфотерных металлов (алюминия, олова, свинца, цинка, хрома и др.), способные образовывать гидроксокомплексы. В присутствии лигандов-комплексонов круг металлов еще более расширяется.
В качестве примеров рассмотрим влияние комплексообразования на растворимость гидроксида меди(II) и хромата свинца(II).
Пример 8. Как влияет на растворимость гидроксида меди(II) добавка в раствор аммиака?
Решение:
Напишем уравнение равновесия для насыщенного раствора Cu(OH)2: Cu(OH)2¯ « Cu2+ + 2OH–
В присутствии аммиака ионы меди связываются, образуя внутреннюю сферу комплекса[Cu(NH3)4]2+:
Cu(OH)2¯ + 4NH3 « [Cu(NH3)4]2+ + 2OH–
В соответствии с принципом Ле Шателье чем больше концентрация аммиака, тем больше равновесие смещается вправо, тем больше растворимость гидроксида меди.
Рассмотренный пример интересен также тем, что реакцией обмена из слабого малорастворимого основания получается сильное растворимое основание (однако причина обмена – образование слабого электролита – комплексного соединения) .
Пример 9. Как влияет pH на растворимость хромата свинца(II)?
Решение:
Напишем уравнение равновесия для насыщенного раствора PbCrO4: PbCrO4¯ « Pb2+ + CrO42–.
а) увеличение кислотности раствора приведет к увеличению растворимости соли вследствие связывания хромат-ионов (см. пример7).
б) увеличение концентрации гидроксид-ионов может привести к образованию гидроксокомплекса (т.к. свинец – амфотерный металл):
PbCrO4¯ + 4OH– «[Pb(OH)4]2– + CrO42–;
таким образом, чем больше концентрация гидроксид-ионов (т.е. чем больше pH раствора, тем больше растворимость соли).
Из (а) и (б) следует, что минимальная растворимость PbCrO4 обеспечивается в растворах с реакцией среды, близкой к нейтральной.
Применение гетерогенных равновесий в качественном анализе. Разделение ионов методом дробного осаждения малорастворимых электролитов.
Образование осадков (часто характерной окраски) является одним из вариантов качественного анализа растворов электролитов. При этом различие в растворимости солей и оснований используется и как основной метод открытия ионов, и как дополнительный, если смесь ионов требуется предварительно разделить.
Пример 10. Предложить способ разделения в водном растворе смеси ионов магния, алюминия и железа(III) при равных их концентрациях в растворе, с(Меn+) = 0,1 M.
Решение:
Все три заданных металла образуют малорастворимые гидроксиды, причем, один из них – гидроксид алюминия – амфотерный; следовательно, при избытке щелочи алюминий легко отделяется от магния и железа.
Для разделения магния и железа рассчитаем pH осаждения их гидроксидов:
– напишем выражение ПР для гидроксида магния:
ПР = [Mg2+]×[OH-]2 = 6×10–10;
– рассчитаем pH начала осаждения гидроксида при с(Mg2+) = 0,1 М:
с(OH–) = ÖПр/с(Mg2+) = Ö6×10–10/0,1 = 7,7×10–5 М, pH = 9,9.
– напишем выражение ПР для гидроксида железа(III):
Пp = [Fe3+]× [OH–]3 = 6×10–38;
– рассчитаем pH начала осаждения гидроксида при с(Fe3+) = 0,1 М:
с(OH–) = 3ÖПР/с(Fe3+) = 3Ö6×10–38/0,1 =8,4×10–13 М, pH = 1,9.
Таким образом, ионы железа и магния легко разделяются при постепенном увеличении pH раствора;
В заключение темы отметим следующее:
Примеры расчетов, показанные выше, не следует абсолютизировать. Растворение – физико-химический процесс, энергетика которого довольно сложная. Так, например, обсуждая влияние природы вещества на его растворимость, необходимо помнить в том числе, что затраты энергиина разрушение связеймежду ионами в твердом веществе при переводе их в раствор зависят не только от химической природы электролита, но и от величины его кристаллов. Чем крупнее кристаллы, тем меньше энергия системы при равном количестве содержащегося в них вещества,тем меньше растворимость. Кроме того, реальные кристаллы всегда имеют дефекты, которые могут быть как механическими, так и физико-химическими (например, обусловленные встройкой в узлы ионной решетки примесных катионов или анионов). На растворимость ионных соединений существенно влияет ионная сила раствора и ряд других факторов, которые обычно рассматриваются в курсах физической, коллоидной и аналитической химии. В процессе изучения этих дисциплин знания, полученные в курсе общей химии, будут все более дополняться и совершенствоваться.
Дата добавления: 2020-07-18; просмотров: 670;











