Водные растворы электролитов. Электролитическая диссоциация.
Известно, что одни вещества в водном растворе проводят электрический ток (электролиты), а другие его не проводят (неэлектролиты). Электролит (распадается на ионы под действием полярных молекул растворителя) проводит электрический ток в результате того, что направленное перемещение его ионов, создает поток электрических зарядов. К числу электролитов относятся вещества с ковалентным полярным или ионным типом связи (основания, кислоты, соли).. Неэлектролит практически не распадается на ионы и поэтому не обладает способностью проводить электрический ток. (сахар, спирт, бензол и другие органические вещества). Растворитель обязательно должен иметь ковалентную полярную связь. В неполярном растворителе (гексан, ацетон, бензол) диссоциации электролитов не происходит.
Распад электролитов на ионы при растворении в воде или расплавлении называется электролитической диссоциацией. Электролитическая диссоциация происходит вследствие взаимодействия растворенного вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Процесс взаимодействия ионов кристаллической решетки с молекулами растворителя называется сольватацией.
6.6 Степень и константа электролитической диссоциации.
Ввиду обратимости процесса электролитической диссоциации в растворах электролитов наряду с ионами присутствуют и недиссоциированные молекулы. Для количественной оценки процесса электролитической диссоциации используется понятие степени электролитической диссоциации. Степень электролитической диссоциации α – это отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул:
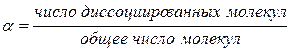
Степень диссоциации определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α =1, или 100%, то электролит полностью распался на ионы. Если же, например, α = 30%, то это означает, что из каждых 100 молекул электролита на ионы распадается 30.
Степень электролитической диссоциации зависит: от природы растворителя, природы растворяемого вещества, температуры и концентрации раствора.
В зависимости от степени диссоциации различают сильные и слабые электролиты. Чем больше α, тем сильнее электролит.
Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации. Т.е. константа электролитической диссоциации – это не что иное, как константа химического равновесия, применимая к распаду слабого электролита. Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:
 АaВb aАx + + bВy –
АaВb aАx + + bВy –
константа диссоциации выразится следующим соотношением:
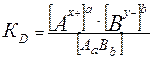
Константа диссоциации (KD или просто К) – отношение произведения равновесных концентраций ионов в степени соответствующих стехиометрических коэффициентов к концентрации недиссоциированных молекул.
Она является константой равновесия процесса электролитической диссоциации; характеризует способность вещества распадаться на ионы: чем выше KD, тем больше концентрация ионов в растворе.
В многоосновных кислотах и многоокислотных основаниях диссоциация происходит ступенчато, причем каждая ступень характеризуется своей величиной степени диссоциации. Так, ортофосфорная кислота диссоциирует по трем ступеням :
| Реакция | Константа диссоциации Kд | Степень диссоциации α | |
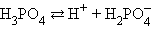
| 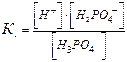
| К1 = 7,1∙10–3 | α = 27 % |
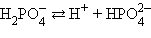
| 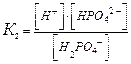
| К2 = 6,2∙10–8 | α = 0,15 % |
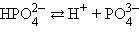
| 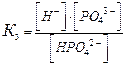
| К3 = 5,0∙10–13 | α = 0,005 % |
Как видно, KD1 > KD2 > KD3. Следовательно, наиболее полно диссоциация протекает по первой стадии.
6.7 Сильные и слабые электролиты.
1.К сильным электролитам относятся электролиты, у которых α > 30%:
а) все щелочи (основания, образованные металлами s-семейства, за исключением бериллия и магния): LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Ba(OH)2 – практически диссоциируют нацело.
Основания диссоциируют в растворе с образованием катиона металла и гидроксид – ионов.
б) некоторые кислоты, например: HCl, HClО4, HBr, HJ, HNO3, H2SO4.
Кислоты диссоциируют в растворе с образованием ионов водорода и ионов кислотных остатков (т. к. связь между катионом водорода и кислотным остатком более полярная, нежели между ионами в самом кислотном остатке).
в) растворимые соли (α ~ 100%)
В солях составными частями являются атомы металлов и кислотные остатки. Именно на эти ионы и происходит распад солей при расплавлении или растворении в воде.
г) кислые, основные и комплексные соли при диссоциации по первой ступени.
Кислые соли распадаются на катионы металла и анионы кислотного остатка:
К2HРО3 → 2К+ + HРО3 2—
При чем по принципу электростатического притяжения ион(ы) водорода (Н+ ) остается рядом именно с анионом кислотного остатка (КОn—), а не с катионом металла (Меn+).
Основные соли распадаются на катионы металла, связанные с гидроскогруппой, и анионы кислотного остатка:
Al(OH)2Cl → Al(OH)2+ + Cl—
При чем по принципу электростатического притяжения гидроксогруппа(ы) (ОН— ) остается рядом именно с катионом металла (Меn+) , а не с анионом кислотного остатка (КОn—).
Комплексные соли распадаются на ионы внешней сферы и комплексный ион (поскольку связь между ионом внешней сферы и комплексным ионом, как правило, ковалентная полярная или ионная, а между ионами или молекулами в самом комплексном ионе чаще донорно – акцепторная).
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3—
2. Слабые электролиты диссоциируют плохо, их α < 3%.
а) все остальные основания;
б) большинство остальных кислот;
в) все нерастворимые растворимые соли;
г) кислые, основные и комплексные соли при диссоциации по второй и последующим стадиям.
3. Электролиты средней силы имеют α от 3% до 30%
(например, H3PO4, H2SO3).
Далее для удобства мы условно будем делить все электролиты на сильные и слабые (относя к последним также и электролиты средней силы).
Дата добавления: 2020-08-31; просмотров: 677;











