Электрическая проводимость растворов электролитов
В отсутствие внешнего электрического поля ионы в растворе находятся в непрерывном хаотическом тепловом движении. При возникновении разности потенциалов они приобретают направленное движение от одного полюса к другому: катионы и анионы движутся в противоположных направлениях. Таким образом, возникает электрический ток. В отличие от металлов, которые характеризуются электронным механизмом электропроводности, в растворах электролитов электричество переносится за счет движения ионов. Поэтому электролиты относят к проводникам второго рода.
Количественная характеристика способности системы проводить электрический ток – электрическая проводимость. Единицей электропроводности растворов электролитов служит удельная электрическая проводимость – величина, обратная удельному сопротивлению:
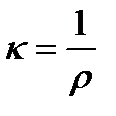 , [Ом-1м-1 = См м-1]
, [Ом-1м-1 = См м-1]
где r – удельное сопротивление
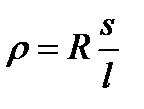 ;
;
R – общее сопротивление проводника, Ом;
l – длина проводника, м;
s – поперечное сечение проводника, м2.
Удельная электрическая проводимость раствора электролита – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь 1 м2 и расположенными на расстоянии 1 м друг от друга.
Удельная электрическая проводимость зависит от
– концентрации электролита;
– вязкости и диэлектрической проницаемости растворителя;
– температуры;
– скорости движения ионов, которая зависит от величины заряда иона и его радиуса с учетом гидратации.
| С |
 При увеличении концентрации электролита удельная электропроводность сначала увеличивается, а затем уменьшается. Такая зависимость характерна как для сильных, так и для слабых электролитов. Это объясняется для слабых электролитов уменьшением степени диссоциации, а для сильных – электростатическим взаимодействием между ионами.
При увеличении концентрации электролита удельная электропроводность сначала увеличивается, а затем уменьшается. Такая зависимость характерна как для сильных, так и для слабых электролитов. Это объясняется для слабых электролитов уменьшением степени диссоциации, а для сильных – электростатическим взаимодействием между ионами.
Наряду с удельной электропроводностью в электрохимии используется молярная электрическая проводимость λ – электрическая проводимость, отнесенная к числу моль растворенного вещества в 1 м3 раствора:
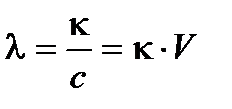 , [См м2 моль-1],
, [См м2 моль-1],
где V – разведение (объем раствора, в котором содержится 1 моль электролита).
Для практических расчетов можно применять производные единицы измерения, например, если выразить концентрацию с в моль/дм3, то связь между молярной и удельной электропроводностью выражается уравнением:
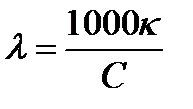 ; [См дм2 моль-1],
; [См дм2 моль-1],
Молярная электрическая проводимость раствора электролита равна электрической проводимости объема раствора электролита, содержащего 1 моль растворенного вещества и находящегося между двумя параллельными электродами площадью 1м2, расположенными на расстоянии 1 м друг от друга.
На рис. кривая I соответствует сильному электролиту, кривая II – слабому электролиту.
| λ¥ |
| I |
| II |
| λ |
| С |
| λ¥ |
В условиях предельного разбавления выполняется закон независимого движения ионов – закон Кольрауша, согласно которому предельная молярная электропроводность раствора электролита равна сумме молярных электропроводностей катиона и аниона при бесконечном разбавлении:
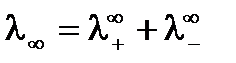 ,
,
где 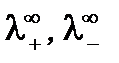 - предельные электропроводности (подвижности) катиона и аниона.
- предельные электропроводности (подвижности) катиона и аниона.
Подвижность иона характеризует количество электричества, которое переносит ион и определяется абсолютной скоростью его движения (т.е. скоростью движения при напряженности электрического поля 1 В/м):
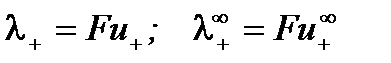 ;
;
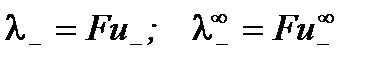 ,
,
где F – число Фарадея F = 96480 Кл/моль;
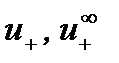 ,
, 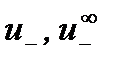 – абсолютные скорости движения катиона и аниона в растворе данной концентрации и при бесконечном разбавлении соответственно.
– абсолютные скорости движения катиона и аниона в растворе данной концентрации и при бесконечном разбавлении соответственно.
Абсолютная скорость движения большинства ионов равна (4 ¸ 8)10-8 м2/(В×с). Исключение составляют только ионы Н+ и ОН–, абсолютные скорости движения которых очень велики.
Абсолютные скорости движения катионов и анионов неодинаковы, то доля электричества, переносимого отдельными ионами может различаться. Для характеристики количества электричества, переносимого данным видом ионов применяют числа переноса. Число переноса – это отношение количества электричества, перенесенного данным видом ионов к общему количеству электричества, перенесенного раствором электролита. Числа переноса катионов t+ и анионов t– можно выразить через электропроводности:
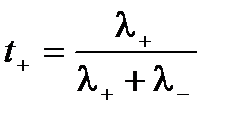 ;
;
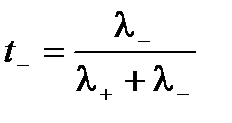 .
.
Таким образом, числа переноса – это относительные подвижности ионов. Сумма чисел переноса катионов и анионов
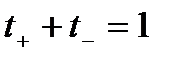 .
.
Влияние межионного взаимодействия на электропроводность раствора отражает коэффициент электрической проводимости fl:
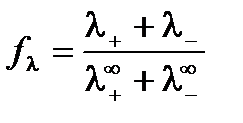 .
.
Взаимосвязь l с fl и степенью диссоциации a можно выразить уравнением:
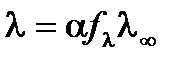 .
.
Для растворов слабых электролитов межионным взаимодействием можно пренебречь, тогда fl » 1, тогда
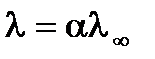
из чего следует
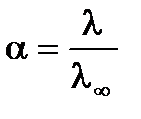 .
.
Таким образом, измерив электропроводность раствора определенной концентрации, можно определить степень диссоциации электролита. Значение λ¥ можно рассчитать по уравнению Кольрауша на основе справочных данных или определить экспериментально. Для этого измеряется электропроводность растворов слабого электролита различной концентрации. В соответствии с законом разбавления Оствальда
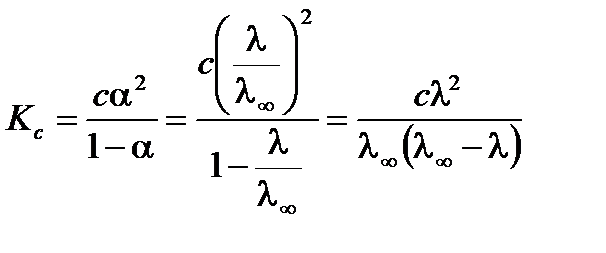 .
.
Приведем уравнение к линейному виду, разделив единицу на правую и левую части:
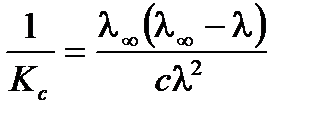 ;
;
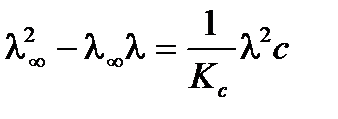 .
.
Разделим на 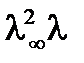 :
:
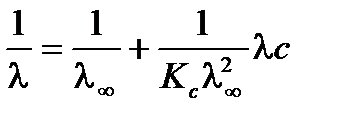 .
.
| а = 1/l¥ |
| β |
| 1/l |
| lс |
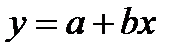 , где
, где 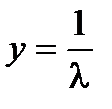 ,
, 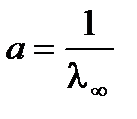 ,
, 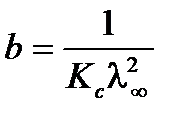 ,
, 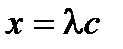 . Для определения λ¥ и Кс строится график в координатах
. Для определения λ¥ и Кс строится график в координатах 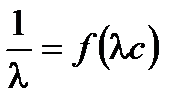 , в соответствии с которым
, в соответствии с которым 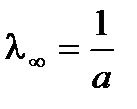 ,
, 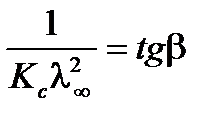 ,
, 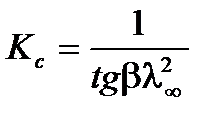 .
.
Зависимость электропроводности раствора слабого электролита от концентрации можно выразить с помощью уравнения Оствальда. Для раствора слабого бинарного электролита (a << 1) в соответствии с законом разбавления Оствальда получим:
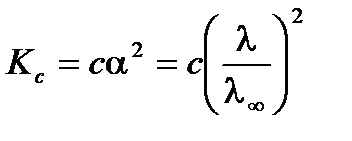 ,
,
тогда
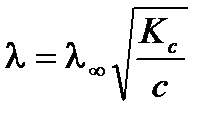 .
.
Из уравнения следует, что молярная электропроводность раствора слабого электролита уменьшается с увеличением концентрации.
Для сильных электролитов α ≈ 1, тогда
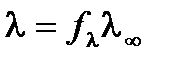 ;
;
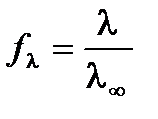 ,
,
следовательно, по значению электрической проводимости раствора данной концентрации можно рассчитать коэффициент электропроводности.
Зависимость молярной электропроводности раствора сильного электролита от концентрации выражается уравнением Онзагера:
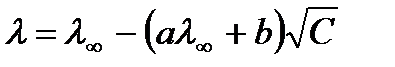 ,
,
где а и b – теоретические коэффициенты, зависящие от диэлектрической проницаемости растворителя, вязкости растворителя и температуры.
Как видно из уравнения Онзагера, с увеличением концентрации электролита электропроводность раствора уменьшается.
С повышением температуры электропроводность растворов электролитов увеличивается. Это объясняется понижением вязкости раствора с возрастанием температуры и увеличением скорости перемещения ионов, а для слабых электролитов также увеличением степени диссоциации.
Дата добавления: 2016-06-22; просмотров: 7864;











