Термодинамика растворов сильных электролитов
В растворах сильных электролитов (даже разбавленных) наблюдаются значительные отклонения от идеальности, что объясняется электростатическим взаимодействием между ионами: притяжением ионов с зарядами разных знаков и отталкиванием ионов с зарядами одного знака. Поэтому при их рассмотрении во всех термодинамических выражениях вместо концентрации необходимо использовать активность.
Рассмотрим сильный электролит, полностью диссоциирующий в растворе на ионы:
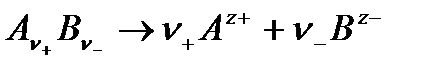
Так как сильный электролит в растворе присутствует в виде ионов, то вводится понятие активностей катиона а+ и аниона а–. Активность электролита связана с активностями катиона и аниона уравнением:
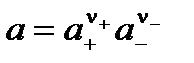 .
.
В связи с тем, что в растворах электролитов одновременно присутствуют и катионы и анионы растворенного вещества, активности отдельных ионов экспериментально определить невозможно, поэтому вводится понятие средней ионной активности a± как среднего геометрического между активностями катиона и аниона:
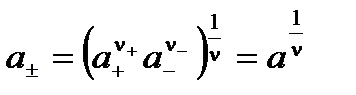 ,
,
где 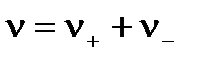 .
.
Активности катиона и аниона можно выразить
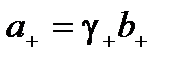 ;
;
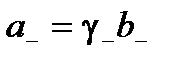 ,
,
где γ+ γ– – коэффициенты активности катиона и аниона;
b+, b– – моляльности катиона и аниона.
Моляльности b+ и b– можно определить
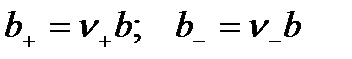 ,
,
где b – моляльность электролита в растворе.
Тогда
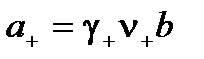 ;
;
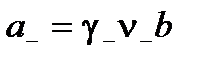 .
.
Подставляем в уравнение для a±:
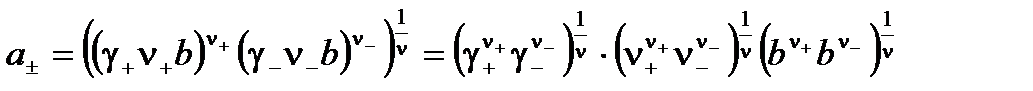 ;
;
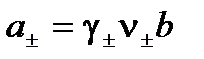 ,
,
где γ± – средний ионный коэффициент активности – среднее геометрическое из коэффициентов активности катиона и аниона:
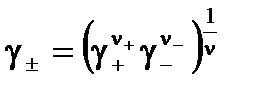 .
.
Значения среднего ионного коэффициента активности для различных электролитов в зависимости от моляльности раствора приведены в справочниках.
Связь между активностью электролита и средней ионной активностью выражается уравнением:
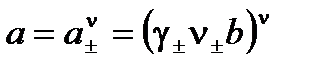 .
.
Средний ионный коэффициент активности можно определить экспериментально различными методами: путем измерения ΔТк или ΔТз раствора, давления пара над раствором и т.д.
Для теоретического расчета среднего ионного коэффициента активности Дебаем и Хюккелем разработана электростатическая теория разбавленных растворов сильных электролитов.
В основу теории Дебая-Хюккеля положены следующие допущения.
1. Ионы рассматриваются как точечные заряды, при этом расстояния между ионами бесконечно велики по сравнению с размерами ионов.
2. Учитывается только электростатическое взаимодействие между ионами, а все другие виды взаимодействий игнорируются.
3. Введено понятие ионной атмосферы, под которой подразумевается статистическое образование из противоположно заряженных ионов вокруг каждого иона, который называется центральным. При этом электростатическое взаимодействие между ионами заменено электростатическим взаимодействием их ионных атмосфер.
4. Диэлектрическая проницаемость раствора принимается равной диэлектрической проницаемости чистого растворителя.
На основе сделанных допущений получено уравнение:
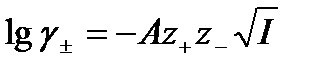 –
–
предельный закон Дебая-Хюккеля
где А – теоретический коэффициент, зависящий от диэлектрической проницаемости растворителя и температуры, для водного раствора при 298 К А = 0,509;
z+, z– – числа зарядов катионов и анионов
I – ионная сила раствора:
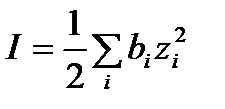 ;
;
bi – моляльность i-го иона;
zi – число заряда i-го иона.
Формулировка: при данной ионной силе раствора средний ионный коэффициент активности электролита в предельно разбавленном растворе является величиной постоянной и не зависит от природы растворенных электролитов.
Теория Дебая-Хюккеля позволяет рассчитать также коэффициент активности отдельного иона γi:
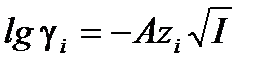 .
.
Закон Дебая-Хюккеля справедлив только для предельно разбавленных растворов, то есть с ионной силой I < 0,01.
Дата добавления: 2016-06-22; просмотров: 3203;











