Адсорбция из растворов электролитов
Адсорбция из водных растворов, как правило, происходит таким образом, что на твердом адсорбенте преимущественно ионы одного вида. Избирательная адсорбция ионов – это процесс фиксации на твердой поверхности ионов противоположного знака. Поглощаться будет в основном тот ион, который имеет большее химическое сродство к веществу твердой фазы и химический потенциал которого в растворе выше, чем в твердой фазе. Избирательную адсорбцию следует считать химическим процессом, т.е. хемосорбцией, поскольку она происходит под действием сил остаточных валентностей и скорость её с повышением температуры в большинстве случаев возрастает.
Избирательная адсорбция ионов подчиняется правилу, сформулированному Ф. Панетом и К.Фаянсом, согласно которому: на поверхности кристаллов из раствора преимущественно адсорбируются те ионы, которые могут образовать с ионами противоположного знака, входящими в кристаллическую решетку, труднорастворимое соединение или достраивать кристаллическую решетку.
Преимущественно адсорбция из раствора или катиона, или аниона зависит от природы адсорбента или от природы ионов – их заряда, радиуса и степени гидратации. Чем больше заряд иона, лучше он адсорбируется. Из ионов с одинаковым зарядом лучше адсорбируется ион. Имеющий наибольший радиус, так как он имеет наименьшую степень гидратации. Гидратная оболочка препятствует адсорбции ионов, и чем она меньше, т.е. чем меньше степень гидратации, тем она адсорбируется лучше.
Катионы и анионы одинакового заряда можно расположить в так называемые лиотропные ряды (ряды Гофмейстера) в порядке уменьшения их сродства к воде (каждый последующий ион гидратируется хуже, чем предыдущий):
Li+>Na+>K+>Rb+>Cs+
Для двухзарядных катионов лиотропный ряд имеет вид:
Mg2+>Ca2+>Sr2+>Ba2+
Однозарядные анионы располагаются в следующем порядке:
CL->Br->NO3->I->SCN->OH-
Рассмотрим адсорбцию ионов раствора КI на поверхности кристалла AgI (рис.8а). На поверхности кристаллов иодида серебра в определенном порядке расположены ионы Аg+ и I–. Иодид-ионы, которые могут образовать с ионами-серебра, находящимися в кристаллической решетке, малорастворимое соединение, адсорбируются на поверхности создавая на ней избыток отрицательных зарядов. Ионы калия не адсорбируются, так как они не образуют с ионами иода нерастворимое соединение, но под действием электростатического притяжения они располагаются вблизи поверхности. Иодид-ионы, сорбированные поверхностью, и ионы калия, находящиеся в жидкой фазе, образуют двойной электрический слой.
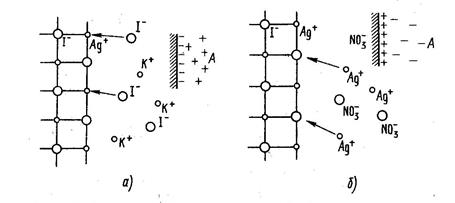
Рис 8 Схема адсорбции иодид-ионов (а) и ионов серебра (б) на поверхности кристалла иодида серебра: А – двойной электрический слой
Если кристаллы AgI находятся в контакте с раствором AgNO3, то на поверхности кристаллов будут адсорбироваться ионы Ag+, ионы NO3- остаются в жидкой фазе (рис.8б).
Таким образом, на поверхности кристаллического твердого тела из раствора адсорбируются тот ион, который входит в состав кристаллической решетки или может образовывать с одним из ионов решетки малорастворимое соединение.
Обменная адсорбция на твердой поверхности и её особенности.
Понятие об ионитах
Обменная адсорбция представляет собой процесс обмена ионов между раствором и твердой фазой – адсорбентом, точнее, обмен ионов между двойным электрическим слоем адсорбента и средой. При этом твердая фаза поглощает из раствора ионы одного знака (катионы или анионы) и вместо них выделяет в раствор эквивалентное число ионов того же знака.
Обменная адсорбция имеет ряд особенностей.
1. Обменная адсорбция специфична, т.е. для данного адсорбента к обмену способны только определенные ионы.
2. Обменная адсорбция протекает более медленно, чем молекулярная адсорбция. Это особенно заметно тогда, когда осуществляется обмен ионов, находящихся в глубине адсорбента. Время обмена ионов, находящихся в глубине адсорбента, лимитируется скоростью диффузии ионов из раствора в глубь адсорбента. Вытесненные из адсорбента ионы затем переходят в раствор.
3. При обменной адсорбции может изменяться рН среды. Это наблюдается тогда, когда обмениваемый адсорбентом ион является водородным или гидроксильным ионом. Если адсорбент заменяет катион на какой-нибудь водородный ион, то последний, поступая в раствор, уменьшает рН среды. Если адсорбент меняет на какой-нибудь анион гидроксильный ион, то рН раствора, наоборот увеличивается. Схематически обмен ионов можно представить следующими реакциями:
Адсорбент –Н+ + Na+ + CL– →Адсорбент – Na+ + H+ + CL–
Адсорбент+ОН– + Na+ + CL– → АдсорбентCL– + Na+ + OH–
Сорбенты, способные к обмену ионов, называют ионообменниками или ионитами. Иониты могут иметь кислотный, основной или амфотерный характер. Вещества кислотного типа обмениваются с раствором катионами и носят название катионитами. Основные сорбенты – аниониты – отдают в раствор анионы, на место которых становятся анионы из раствора. Амфотерные иониты содержат и катионные, и анионные обмениваемые группы. Эти иониты могут сорбировать одновременно катионы и анионы. Свойствами кислых сорбентов обладают алюмосиликаты (цеолиты, пермутиты), силикагель, целлюлоза и многие другие вещества. К основным сорбентам относятся, например, гидроксиды алюминия, железа. Амфотерные иониты – это синтетические вещества типа H+SO3–―R―N+(CH3)3OH― , где R – органическая полимерная основа.
Большинство ионитов – твердые соединения; многие из них после набухания образуют мягкие гели. Существуют и жидкие иониты – низкомолекулярные соединения, содержащие в молекулах ионную группу и большой гидрофобный радикал. Эти ионы растворимы в неполярных жидкостях и используются для проведения экстракций.
Ионообменные смолы – это высокомолекулярные нерастворимые соединения, способные набухать в водных растворах, поглощая значительное количество воды, и высвобождать ионы в процессе электролитической диссоциации. Высвободившиеся ионы замещаются на другие присутствующие в растворе ионы, имеющие большее сродство к ионообменнику. Процесс ионного обмена обратим, и направление его зависит главным образом от концентраций обмениваемых ионов. Природные и синтетические ионообменники могут быть органической и неорганической природы. Неорганические ионообменники имеют кристаллическую структуру различного типа; способные к обмену ионы содержатся в их решетках. Органические полимерные ионообменники имеют пространственную структуру из сшитых полимерных цепей, на которых нерегулярно расположены ионогенные группы (рис.18). Функциональные группы определяют функциональные свойства свойства ионитов, поэтому их называют функциональными группами.Функциональные группы ионитов ковалентно связаны с цепочками основы – матрицы ионита. Свободно перемещающиеся противоионы связаны с ионогенными группами электростатически и могут стехиометрически обмениваться с другими ионами, обладающими тем же зарядом. Помимо противоионов в растворе имеются сопутствующие им коионы, заряженные одноименно с потенциаобразующими ионами. В результате ионного обмена сохраняется электронейтральность как ионита, так и раствора.
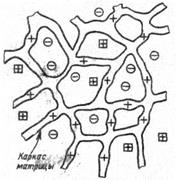 |
Рис 9 Структура органического ионита. Свободно перемещающиеся противоионы (–) и коионы (+)
Основными достоинствами синтетических ионообменных смол как адсорбентов являются их большая обменная емкость, химическая стойкость и механическая прочность, разнообразие кислотно-основных свойств.
Значение ионного обмена для фармации чрезвычайно велико. Применяя иониты, можно умягчать жесткую воду или опреснять засоленную и получать пригодную для фармацевтических целей. В стадии изучения находится вопрос о медицинском применении ионитов путем введения их высокодисперсных форм непосредственно в желудочно-кишечный тракт для связывания ядовитых веществ, токсинов, а также для нормализации ионного баланса в организме.
Дата добавления: 2016-11-04; просмотров: 7622;











