Равновесие в растворах слабых электролитов
Пусть имеется разбавленный раствор слабого электролита, диссоциация которого происходит в соответствии с уравнением:
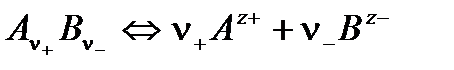
Если исходная концентрация данного электролита С, а степень диссоциации – α, то при установившемся равновесии концентрация недиссоциированных молекул 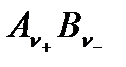 равна
равна 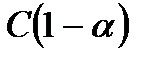 , концентрация катионов
, концентрация катионов 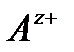 равна
равна 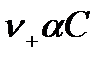 , анионов
, анионов 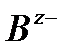 -
- 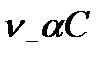 .
.
В соответствии с законом действия масс константа равновесия реакции равна:
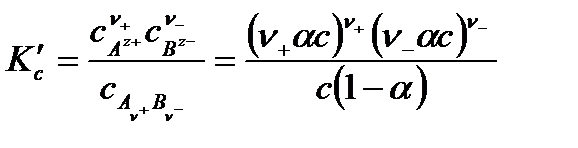 .
.
Преобразуем:
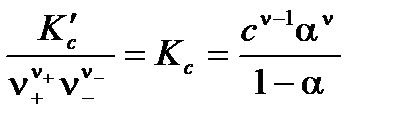 (4.1)
(4.1)
где 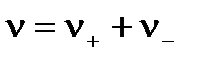 .
.
Уравнение (4.1) – закон разбавления Оствальда.
Для бинарного электролита (т.е. электролита, при диссоциации которого образуется два иона, например KNO3) уравнение имеет вид:
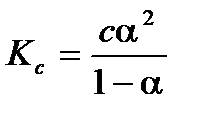 .
.
Константа равновесия Кс зависит от температуры и природы растворителя, но не зависит от концентрации электролита.
Зависимость константы диссоциации слабого электролита от температуры выражается уравнением изохоры:
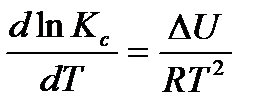 .
.
Теплота диссоциации ∆U > 0, поэтому с повышением температуры Кс и α всегда увеличиваются.
Закон разбавления Оствальда применим только для разбавленных растворов, свойства которых близки к свойствам идеальных растворов. В концентрированных растворах расстояние между ионами уменьшается, в результате чего увеличиваются силы электростатического взаимодействия и возникают значительные отклонения от свойств идеальных растворов. Поэтому для описания равновесий в таких растворах вместо концентраций компонентов необходимо применять активности:
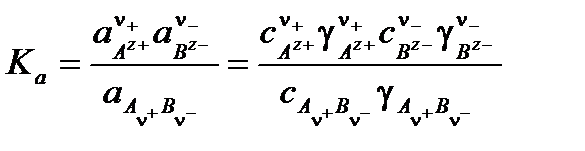 ,
,
где Ка – термодинамическая константа диссоциации.
Термодинамическая константа диссоциации не зависит от концентрации электролита и при постоянной температуре является константой.
Дата добавления: 2016-06-22; просмотров: 2852;











