Мономолекулярные обратимые (двусторонние) реакции первого порядка
Обратимые реакции могут быть I и II порядка 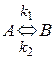
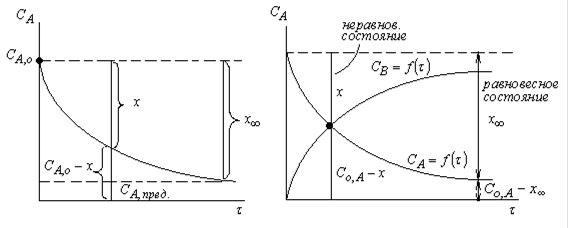
Обратимая реакция идет до равновесия в течении 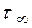
 |  |  |
- равновесные концентрации
Суммарная скорость реакции равна разности прямой и обратной реакций
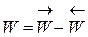 (4.1)
(4.1)
В любой момент времени
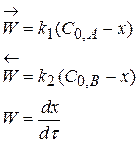
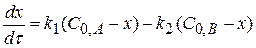 (4.2)
(4.2)
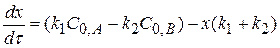 (4.3)
(4.3)
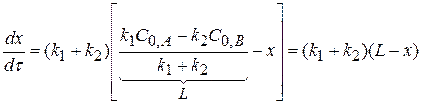
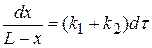 (4.4)
(4.4)
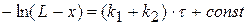
При 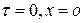 , const = − ln L
, const = − ln L
Тогда уравнение (1.46) можно записать
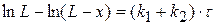
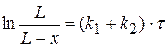
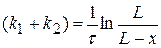 (4.5)
(4.5)
Уравнение (4.5) позволяет найти сумму (k1 + k2), но не дает возможности найти k1 и k2. Найти значение k1 и k2 можно, исходя из равновесия прямой и обратной реакции, когда 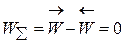 , т.е.
, т.е. 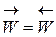
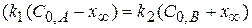
Константа равновесия реакции
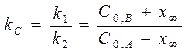 (4.6)
(4.6)
Преобразуем выражение L, поделив на k2:
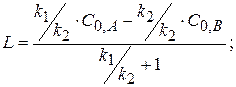
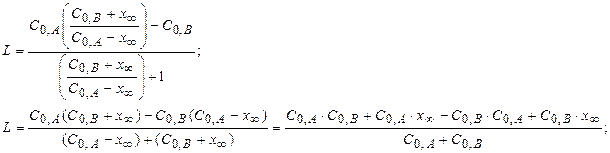
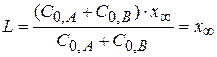 (4.7)
(4.7)
Исходя из выражения L уравнения (1.50) можно записать
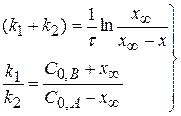 совместное решение этих (4.8)
совместное решение этих (4.8)
двух уравнений позволяет найти значение k1 и k2.
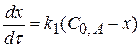
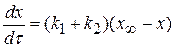
Мономолекулярные параллельные односторонние реакции
Реакции называются параллельными, если в каждой реакции в качестве исходного принимает участие одно и тоже вещество. Эти реакции могут быть I и II порядка.
 Рассмотрим параллельную реакцию I порядка, характерную для органического синтеза. Каждая реакция дает свой продукт.
Рассмотрим параллельную реакцию I порядка, характерную для органического синтеза. Каждая реакция дает свой продукт.

| 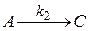
| |||
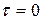
| 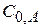
| 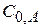
| ||
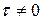
| 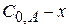
| 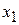
| 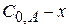
| 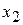
|
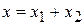
|
Скорость параллельной реакции равна
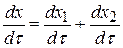 (4.9)
(4.9)
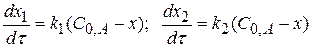
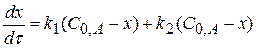 (4.10)
(4.10)
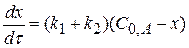
Разделим переменные и проинтегрируем
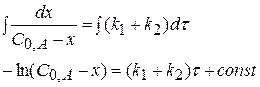
При 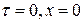
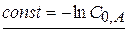
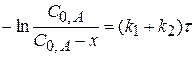 (4.11)
(4.11)
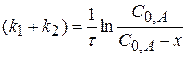 (4.12)
(4.12)


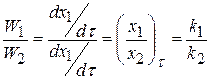
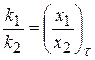 (4.13)
(4.13)
Дата добавления: 2018-05-10; просмотров: 1374;











