Изменение энтропии при протекании процессов в идеальном газе.
Второй закон термодинамики для бесконечно малых изменений:
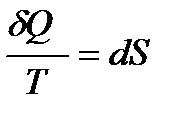 .
.
Преобразуем
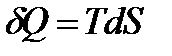 .
.
Согласно I закону термодинамики,
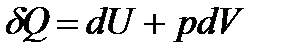 .
.
Изохорная теплоемкость идеального газа
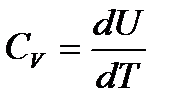 ,
,
тогда
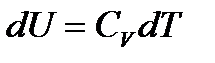 .
.
Согласно уравнению Менделеева-Клапейрона для 1 моль идеального газа
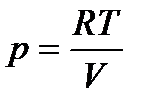 .
.
С учетом этого получим
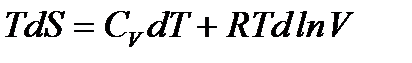
Поделим левую и правую часть уравнения на Т:
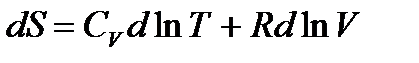 .
.
После интегрирования в определенных пределах получаем
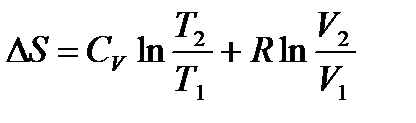 ,
,
а для n моль идеального газа
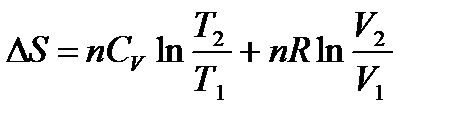 . (1.20)
. (1.20)
Выразим внутреннюю энергию идеального газа через энтальпию:
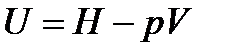 .
.
Найдем dU
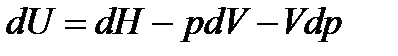
и подставим в уравнение II закона термодинамики:
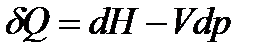 .
.
Выразим объем через давление, используя уравнение Менделеева-Клапейрона:
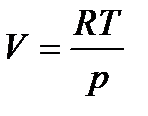 .
.
Изобарная теплоемкость идеального газа:
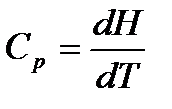 ,
,
тогда
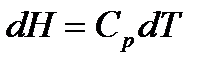
С учетом этого получаем
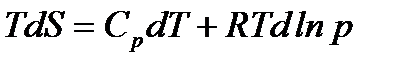
Разделим на Т
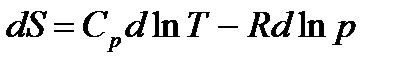 .
.
После интегрирования в определенных пределах для n молей газа
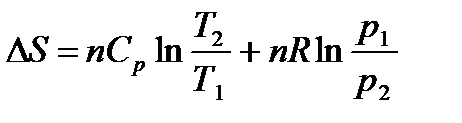 (1.21)
(1.21)
Применим уравнения (1.20) и (1.21) к процессам, протекающим при
V = const, Т = const и р = const.
При V = const V2 = V1; ln(V2/V1) = 0, а Т2/Т1 = р2/р1:
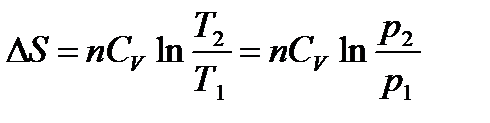 .
.
При р = const Т2/Т1 = V2/V1, тогда
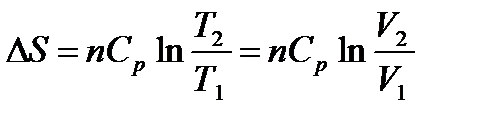 .
.
При Т = const:
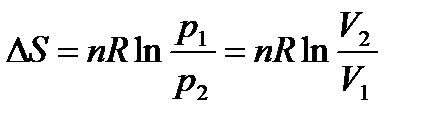 .
.
Изменение энтропии при фазовых превращениях
Фазовое превращение – процесс, связанный с изменением агрегатного состояния вещества.
Характерной особенностью этих процессов является то, что они протекают при постоянной температуре, равной Тф.п. (температуре фазового перехода).
Согласно II закону термодинамики
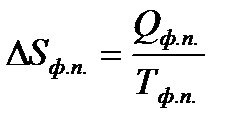 ,
,
где Qф.п. – тепловой эффект фазового перехода.
Для изотермического процесса, протекающего при р = const:
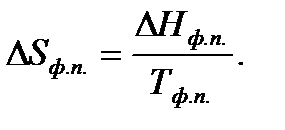
Дата добавления: 2016-06-22; просмотров: 2443;











