Необратимые и обратимые химические реакции. Химическое равновесие. Принцип Ле-Шателье. Констранта равновесия.
Все химические реакции можно разделить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца (до полного расхода одного из реагентов), а в обратимых ни одно из реагирующих веществ не расходуется полностью, потому что обратимая реакция может протекать как в прямом, так и в обратном направлении.
Пример необратимой реакции:
Zn + 4HNO3 → Zn(NO3)2 + 2NO2↑ + 2H2O
Пример обратимой реакции:
H2 + I2 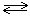 2HI
2HI
Вначале скорость прямой реакции vпр велика, а скорость обратной реакции vоб равна нулю
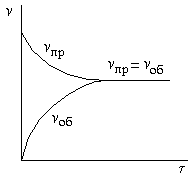
| Зависимость скоростей прямой и обратной реакций от времени τ. При равенстве этих скоростей наступает химическое равновесие. |
По мере протекания реакции исходные вещества расходуются, и их концентрации падают. Одновременно появляются продукты реакции, их концентрации возрастают. Вследствие этого начинает идти обратная реакция, причем ее скорость постепенно увеличивается. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает химическое равновесие. Оно является динамическим, т.к., хотя концентрации веществ в системе остаются постоянными, реакция продолжает протекать как в прямом, так и в обратном направлении.
При равенстве vпр и vоб можно приравнять их выражения согласно закону действия масс *. Например, для обратимого взаимодействия водорода с иодом:
kпр·[H2]·[I2]=kоб·[HI]2 или
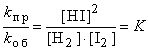
Отношение констант скорости прямой и обратной реакций (K) называется константой равновесия. При постоянной температуре константа равновесия представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов и исходных веществ, которое устанавливается при равновесии. Величина K зависит от природы реагирующих веществ и от температуры.
Система находится в состоянии равновесия до тех пор, пока внешние условия сохраняются постоянными. При увеличении концентрации какого-либо из веществ, участвующих в реакции, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
Когда в реакции участвуют газы, равновесие может нарушаться при изменении давления:
2NO + O2 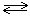 2NO2
2NO2
vпр=kпр·[NO]2·[O2]; vоб=kобр·[NO2]2
При увеличении давления, например, в 2 раза концентрация каждого газа возрастет в 2 раза, и новые скорости реакций станут равными vпр´ и vоб´:
vпр´=8vпр; vоб´=4vоб
Неодинаковое изменение скоростей прямой и обратной реакций связано с тем, что в левой и правой частях уравнения реакции различно число молекул газов. В связи с этим равновесие при возрастании давления сдвигается в сторону уменьшения числа молекул газов, т.е. в сторону понижения давления.
Дата добавления: 2016-06-22; просмотров: 2293;











