ЗАКОНЫ КОНОВАЛОВА. АЗЕОТРОПНЫЕ СМЕСИ.
Соотношения между составами равновесных растворов и их паров, а также общим давлением пара над раствором были установлены Д.П. Коноваловым в 1881 году и носят название законов Коновалова.
Первый закон Коновалова гласит: общее давление пара над раствором растёт с ростом доли в растворе того компонента, который богаче представлен в паре, т. е. более легколетучего компонента. На этом явлении основана фракционная перегонка (ректификация), позволяющая разделить смесь взаимно–растворимых жидкостей.
Второй закон Коновалова касается более частных случаев. Для некоторых реальных растворов с большими отклонениями от закона Рауля на кривых «общее давление пара – состав» могут появляться минимумы или максимумы.
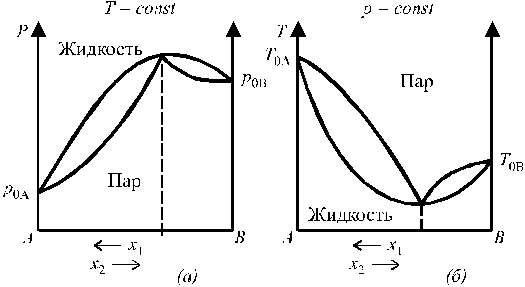
Второй законКоновалова гласит: максимум на кривой общего давления соответствует минимуму на кривой температур кипения и отвечает такому равновесию раствора и его насыщенного пара, при котором составы фаз одинаковы, и наоборот. Диаграммы состояния бинарных систем с максимумом на кривой давления пара и минимумом на кривой температур кипения представлены на рис. 10.
Смеси, у которых раствор и пар одинаковы по составу, называются азеотропными, или нераздельнокипящими. Путём перегонки азеотропные растворы не разделяются (составы фаз равны). Но их можно разделить следующими методами:
— путём химического связывания одного из компонентов;
— путем добавления в систему третьего компонента;
 |
— путем ректификации на двух последовательных колонках при различных давлениях.
Рис. 10. Диаграммы состояния бинарных систем с максимумом
на кривой давления пара (а) и минимумом на кривой температур кипения (б).
Примерами азеотропных смесей с минимумами на кривых температур кипения являются растворы, содержащие Н2О и С2Н5ОН (96,5%), метанол и ацетон, и другие. Примерами азеотропных смесей с максимамуми на кривых кипения являются растворы, содержащие Н2О и НСl (20%), ацетон и хлороформ, и другие.
Ограниченная взаимная растворимость жидкостей.
Дата добавления: 2016-06-18; просмотров: 6448;











