ДИАГРАММЫ СОСТОЯНИЯ ДВУХКОМПОНЕНТНЫХ СИСТЕМ.
Для двухкомпонентных гомогенных (однофазных) систем (Ф = 1) по правилу фаз Гиббса имеем:
f = K + 2 – Ф = 2 + 2 – 1 = 3, (6.1)
т. е. для описания состояния таких систем достаточно трёх переменных: давления, температуры и концентрации. Следовательно, для её графического изображения надо использовать объёмную (трёхмерную) диаграмму. Чтобы свести её к плоской, необходимо сократить число переменных. Поэтому при изучении конденсированных систем чаще всего строят диаграммы «точка кристаллизации (плавления) – состав» при постоянном давлении (обычно р = 1 атм.), благодаря чему диаграмма становится плоской.
Рассмотрим диаграммы состояния (растворимости) двухкомпонентных систем, описывающие зависимости температуры начала кристаллизации расплава от его состава (при постоянном давлении).
1. Плоская диаграмма плавкости (р = const) двухкомпонентных систем с неограниченной растворимостью компонентов в жидком состоянии и взаимной нерастворимостью в твердом состоянии (без образования химических соединений).
 | |||
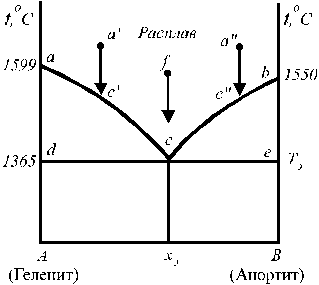 | |||
Такие диаграммы характерны для веществ, полностью растворимых в жидком состоянии (при смешении жидких компонентов образуются гомогенные растворы во всей области концентраций) и не образующих твёрдых растворов (например, Cd – Bi, KCl – LiCl). На рис. 12 представлена диаграмма растворимости системы геленит (2CaO×Al2O3×SiO2) — анортит (CaO×Al2O3×2SiO2).
Рис. 12. Диаграмма состояния простой Рис. 13. Диаграмма состояния системы
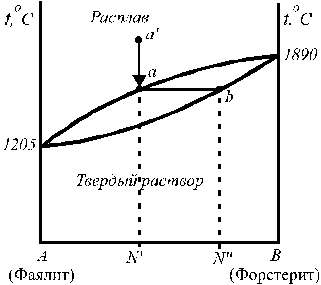
(с одной эвтектикой) фаялит (Fe2SiO4) — форстерит (Mg2SiO4).
двухкомпомпонентной системы.
В случае, когда компоненты не образуют химических соединений и твёрдых растворов, добавки одного из компонентов всегда понижают температуру кристаллизации другого, т. е. если к жидкому компоненту (например, гелениту) добавить растворимый в нем компонент (анортит), то температура начала кристаллизации такого расплава будет ниже температуры плавления чистого компонента (геленита). Так, на рис. 12 это понижение проявляется на кривых aс и bc. Кривые, показывающие зависимость (ход) температуры начала кристализации смесей от состава, называются кривыми ликвидуса. Выше линий ас и bc геленит и анортит могут находиться только в расплавленном состоянии. Точка с, являющаяся точкой пересечения кривых ликвидуса, называется эвтектической точкой. В этой точке система инвариантна (f = 2 + 1 – 3 = 0). Она отвечает определенному составу эвтектики и самой низкой температуре кристализации смеси, называемой эвтектической температурой. Эвтектика – не твердый раствор, а микрогетерогенная смесь кристалов (в нашем случае кристалов геленита и анортита).
Линия, отвечающая температурам конца кристализации расплавов называется линией солидуса. На рис. 12 она представлена изотермой dce, проходящей при температуре 1365 оС.
Области диаграммы acd и bсe – гетерогенны; всякий расплав (раствор), фигуративная точка (точка на диаграмме состояния) которого находится в этой области, распадается на две равновесные фазы: кристаллы одного из компонентов (минералов) и жидкий расплав (раствор) определенного состава. Поле Adcxэ отвечает твердым смесям кристалов геленита и эвтектики. Поле xэBec охватывает твердые смеси кристалов анортита и эвтектики.
2. Диаграммы состояния двухкомпонентных систем, неограниченно взаимно растворимых как в жидком ,так и в твёрдом состоянии.
Некоторые бинарные системы могут образовывать твердые растворы с неограниченной растворимостью в твердой фазе (рис. 13).
На диаграмме, представленной на рис. 13, верхняя кривая (ликвидус) описывает зависимость температуры кристаллизации (плавления) от состава жидкого раствора (расплава), нижняя кривая (солидус) — зависимость температуры плавления от состава твердого раствора. Если исходить из точки а¢ (расплав состава N¢) и отнимать теплоту, то в точке а расплав будет предельно насыщен относительно твердого раствора (точка b) состава N¢¢.
В случае неидеальности жидкого раствора, образуемого компонентами, на диаграмме состояния появляются экстремумы (например, для системы Сu – Au на диаграмме состояния есть минимум Тпл).
Дата добавления: 2016-06-18; просмотров: 6588;











