Кинетическое уравнение обратимой реакции первого порядка
Изменение концентрации исходных веществ и продуктов реакции во времени в случае протекания обратимой реакции можно показать на примере реакции первого порядка: АÛВ.
Пусть в начальный момент времени при t=0 концентрация исходного вещества А равняется C0A, а концентрация продукта В – C0B.
Согласно закону действующих масс скорость прямой и обратной реакций будут описываться уравнениями
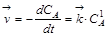 ,
, 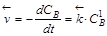 .
.
Скорость двухсторонней реакции определяется скоростью как прямого, так и обратного процессов:
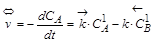 ,
, 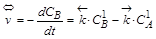 .
.
Кинетические уравнения содержат три переменные: CA,CB и t. Для интегрирования одну необходимо исключить. Это можно сделать на основе материального баланса. Пусть к моменту времени t концентрации реагентов изменятся на величину x. Тогда CA = CA0 – x,а CB= CB0 + x,
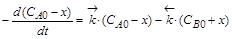 ,
,
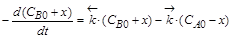 .
.
Если обозначить 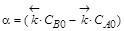 ,
, 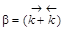 , то можно преобразовать первое уравнение (или второе, результат будет одинаков) к виду
, то можно преобразовать первое уравнение (или второе, результат будет одинаков) к виду
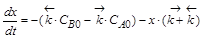 ,
, 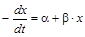 ,
,
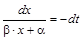 ,
, 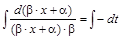 ,
,
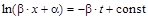 при t=0 x=0
при t=0 x=0 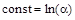 ,
,
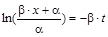 ,
, 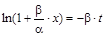 ,
, 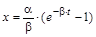 ,
,
| |
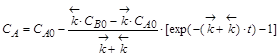 ,
,
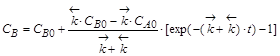 .
.
Изменение концентрации веществ А и В во времени приведено на рис.2.9.


Рис. 2.9. Изменение концентрации веществ А и В во времени при протекании обратимой реакции первого порядка АÛВ.  ; C0A=1; C0B=0
; C0A=1; C0B=0
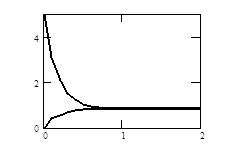
Рис. 2.10. Изменение во времени скоростей прямой и обратной реакций первого порядка АÛВ: 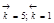 ; C0A=1; C0B=0
; C0A=1; C0B=0
По достижении равенства скоростей прямой и обратной реакции (рис. 2.10) концентрации исходного вещества и продукта изменяться не будут (в данном примере САр=0,167; СВр=0,833), система придет в состояние равновесия.
Дата добавления: 2020-02-05; просмотров: 677;











