Фотохимические реакции
Кванты электромагнитного излучения видимого и ультрафиолетового участков спектра могут передавать свою энергию атомам и молекулам, что приводит к их возбуждению. Наличие в системе возбужденных частиц обеспечивает протекание реакций, которые без освещения идут либо с малой скоростью, либо их самопроизвольное протекание термодинамически невозможно. Возбужденные молекулы могут также диссоциировать, например, с образованием свободных радикалов.
Величина энергии кванта света должна быть достаточной для создания активных частиц, поэтому фотохимические реакции протекают только под действием света с определенной, характерной для взаимодействующих веществ, длиной волны.
Протекание фотохимических реакций подчиняется следующим общим законам.
1. Химическая реакция происходит только за счет поглощенной веществом энергии светового излучения (первый закон фотохимии).
Поглощение света в веществе описывается законом Бугера-Ламберта-Бера (Bouguer-Lambert). Интенсивность света I, прошедшего через слой поглощающего вещества толщиной l, определяется выражением
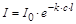 ,
,
где I0 – интенсивность излучения на входе в слой поглощающего вещества; k – коэффициент поглощения; c – концентрация поглощающего вещества.
Таким образом, энергия излучения, поглощенная веществом в единицу времени, равна:
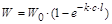 ,
,
где W0 – мощность светового потока, количество световой энергии, переносимое излучением за единицу времени (Дж/с º Вт).
2. Каждый поглощенный квант света в первичном акте вызывает превращение только одной молекулы (второй закон фотохимии).
Число молекул, распавшихся или образовавшихся при первичном акте фотохимической реакции (n0), пропорционально числу квантов поглощенного излучения и соответственно количеству поглощенной световой энергии (W):
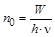 , где h×n–энергия кванта.
, где h×n–энергия кванта.
Фотохимические реакции сложные, их продукты, как правило, являются результатом превращения частиц, образовавшихся в первичном акте. При протекании промежуточных стадий возможны процессы, приводящие к уменьшению выхода конечных продуктов. Первичный фотохимический акт может также являться актом зарождения разветвленного цепного процесса, что приводит к значительному увеличению выхода конечных продуктов реакции. Характеристика, показывающая количество молекул продуктов фотохимического процесса, приходящихся на один квант поглощенного света, называется квантовым выходом реакции (g).
Скорость фотохимической реакции (v) – число молекул, образовавшихся (или израсходовавшихся) в единицу времени в результате фотохимического превращения 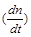 , равна:
, равна:
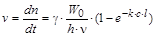 .
.
Если излучение полностью поглощается в веществе (k®¥), то скорость фотохимической реакции не зависит от концентрации реагирующих веществ (реакция нулевого порядка). Число молекул, распавшихся или образовавшихся за время облучения t, равно:
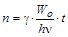 .
.
По величине квантового выхода фотохимические реакции разделяются на реакции с g =1; g<1; g>1; g>>1.
Пример.
| Реакция | Молекула, поглощающая свет | Поглощаемый свет l, нм | Квантовый выход g |
| H2+O2®H2O2 | O2 | 303-500 | |
| 2NH3®H2+3N2 | NH3 | »0,2 | |
| 2HI® H2+I2 | HI | 207-282 | |
| H2+Cl2®2HCl | Cl2 | 303-500 | 104-106 |
Дата добавления: 2020-02-05; просмотров: 682;











