Зависимость скорости реакции от температуры
Поскольку концентрации реагирующих веществ при постоянном объеме не зависят от температуры, то температурная зависимость скорости сложной химической реакции определяется зависимостью от температуры константы скорости. Для большинства сложных реакций эта зависимость может быть описана уравнением Аррениуса:
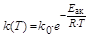 .
.
Таким образом для реакции nAA + nBB =nDD + nEE можно записать:
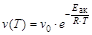 , где
, где 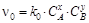 .
.
Для сложных реакций энергия активации Еак, как правило, есть эффективная суммарная величина, связанная со всеми стадиями процесса. Фактически она является параметром, отражающим степень зависимости константы скорости (скорости) реакции от температуры, и обычно определяется экспериментально.
Зависимость скорости реакции от температуры можно также характеризовать температурным коэффициентом g, который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10°:
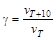 ®
® 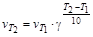 .
.
Температурный коэффициент связан с энергией активации реакции соотношением 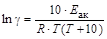 .
.
Для реакций, имеющих при температурах, не сильно отличающихся от »300 К, заметное протекание во времени (не слишком быстрых, но и не слишком медленных), энергия активации составляет величину порядка Еак ~ 50 – 100 кДж/моль. В этих условиях температурный коэффициент g » 2 – 4. Эту закономерность опытным путем установил Вант–Гофф (van¢t Hoff): при увеличении температуры на 10°С скорость химической реакции возрастает примерно в 2 – 4 раза. При помощи этого эмпирического правила Вант-Гоффа можно оценить изменение скорости реакции при изменении температуры.
Пример.Время протекания реакции А®В при температуре Т = 53°С составило Dt=100 с (концентрация вещества А уменьшилась в 1000 раз). Сколько времени потребуется на ее протекание при 73°С и 23°С?
Примем, что температурный коэффициент g » 3. Тогда при увеличении температуры с 53°С до 73°С скорость реакции возрастет в 9 раз:
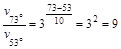 .
.
Поскольку средняя скорость реакции 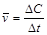 , то при ее увеличении время протекания реакции уменьшится в такое же число раз и составит величину Dt=100/9 = 11,1 с. При уменьшении температуры с 53°С до 23°С скорость реакции уменьшится в 27 раз:
, то при ее увеличении время протекания реакции уменьшится в такое же число раз и составит величину Dt=100/9 = 11,1 с. При уменьшении температуры с 53°С до 23°С скорость реакции уменьшится в 27 раз: 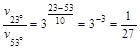 , а время протекания реакции увеличится в такое же число раз: Dt=100×27 =270 с.
, а время протекания реакции увеличится в такое же число раз: Dt=100×27 =270 с.
Дата добавления: 2020-02-05; просмотров: 704;











