Температурный интервал кристаллизации
В установившемся режиме скорость образования центров кристаллизации vоцк равна скорости их распада vрасп.
vоцк= vрасп
Число распадающихся в единицу времени центров кристаллизации пропорционально их концентрации С и скорости отвода U молекул от зародыша в жидкости: vрасп ~ C ∙ U. Концентрация кристаллических зародышей С зависит от работы их образования Акр=ΔGкр:
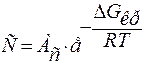 ;
;
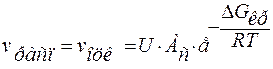 ,
,
Ас – постоянная.
Так как транспорт является активационным процессом, то
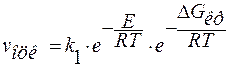 ,
,
k1 — константа скорости образования центров кристаллизации.
Е — энергия активации процесса транспорта.
Первый экспоненциальный множитель характеризует скорость молекулярного обмена между зародышем и материнской фазой, второй экспоненциальный множитель – вероятность образования зародыша новой фазы. Для трёхмерного зародыша
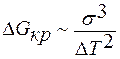 ,
,
поэтому
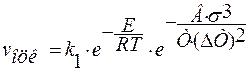 ,
,
В – включает постоянные величины;
Т↑ 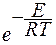 ↑
↑ 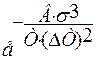 ↓.
↓.
Вторая экспонента с ростом температуры уменьшается, так как при повышении температуры разность ΔТ = (То – Т) уменьшается интенсивнее, чем растет температура Т (рис. 3.9).
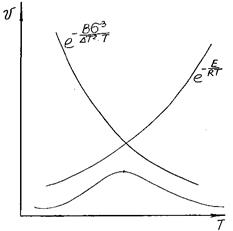
Рис. 3.9. Изменение с температурой скорости образования
центров кристаллизации
Увеличение vоцк при малых переохлаждениях расплава вызвано ростом числа зародышей. Дальнейшее увеличение переохлаждения приводит к падению vоцк из-за уменьшения подвижности частиц при понижении температуры.
Для силикатных расплавов, строение которых обусловлено направленными ковалентными связями, энергия активации диффузии Е велика (диффузионная подвижность мала). Поэтому экспоненциальный множитель, характеризующий перемещение частиц, интенсивно уменьшается при понижении температуры. Как следствие, при охлаждении практически сразу достигается такая температура, при которой из-за транспортных затруднений кристаллизация невозможна. При понижении температуры расплава перемещение частиц существенно замедляется, следовательно силикатные расплавы застывают без значительной перестройки структуры, т.е. стеклуются. С увеличением скорости охлаждения структура стекла во всё большей степени сохраняет структуру расплава. Стекло – это переохлаждённая жидкость.
В жидких металлах атомы обладают большой диффузионной подвижностью, энергия активации диффузии Е мала по сравнению с ΔGкр. Первый экспоненциальный множитель практически не меняется с температурой, так как показатель степени достаточно мал, близок к нулю. При кристаллизации металлов наблюдается лишь восходящая ветвь зависимости vоцк от переохлаждения ΔТ, что соответствует практически мгновенной, массовой кристаллизации металла при температуре плавления. Поэтому металлы трудно переохлаждаются и не переходят в стеклообразное состояние при обычных скоростях охлаждения. Зафиксировать структуру жидкого металла удаётся лишь при практически мгновенном контактном охлаждении расплава. Металл сливают через узкую щель огнеупорной насадки на быстро вращающийся водоохлаждаемый бронзовый барабан. Получают очень тонкую ленту аморфного металла (толщиной несколько десятков микрометров). Получать металлическое стекло большей толщины принципиально невозможно.
Рассуждения, подобные использованным при выводе уравнения для скорости образования центров кристаллизации vоцк, позволяют получить формулу для расчёта скорости линейного роста кристаллов vлрк:
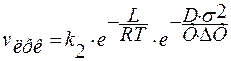 ,
,
k2 – константа скорости линейного роста кристаллов;
L – энергия активации поверхностной диффузии;
D – постоянная;
σ – межфазное натяжение на границах двухмерного зародыша.
Зависимость vлрк = vлрк (ΔТ) аналогична рассмотренной выше для vоцк = f(ΔТ). Однако при зарождении кристаллов действие переохлаждения сильнее, чем при их росте. Это вызвано тем, что в последнем уравнении величина ΔТ входит в первой степени. В уравнение для образования центров кристаллизации переохлаждение входит в квадрате. Поэтому максимум vоцк сдвинут по сравнению с максимумом vлрк в сторону больших переохлаждений.
Способность расплава к переохлаждению зависит от того, насколько раздвинуты эти максимумы (рис. 3.10).
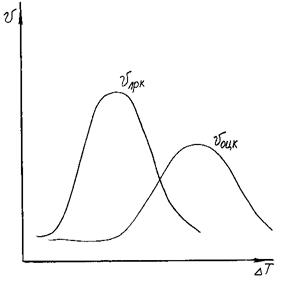
Рис. 3.10. Взаимное расположение температурных областей
образования центров кристаллизации и их роста
Если отсутствует область температур ΔТ, в которой оба процесса протекают с достаточными скоростями, расплав не может закристаллизоваться вообще (рис. 3.11).
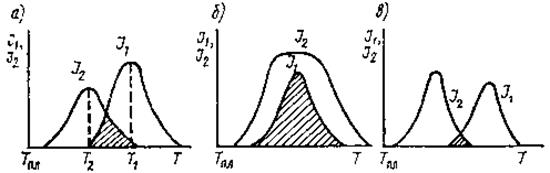
Рис. 3.11. Различные варианты расположения температурных
областей возникновения кристаллической фазы и её роста
По относительному расположению кривых выделяют три характерных случая:
а) расплав кристаллизуется в интервале температур Т1–Т2;
б) расплав интенсивно кристаллизуется в широком интервале температур, он не склонен к стеклообразованию;
в) расплав склонен к стеклообразованию, так как температурная область кристаллизации мала.
Кристаллизационная способность стёкол определяется следующими параметрами:
1. Температурным интервалом кристаллизации.
2. Верхней температурой кристаллизации.
3. Скоростью роста кристаллов.
Для стекла надо иметь:
1) узкий интервал кристаллизации;
2) малую скорость кристаллизации;
3) верхняя температура кристаллизации должна лежать ниже температуры выработки.
Наиболее опасными, с точки зрения кристаллизации, являются температурные зоны студки и выработки. Кристаллизации способствуют границы раздела фаз: стекло–огнеупор, стекло–воздух, газовые пузыри, свили, инородные включения.
vоцк > vлрк – образуются многочисленные кристаллические включения малого размера;
vоцк < vлрк – имеем отдельные крупные кристаллические включения.
Для расплавов с высокой вязкостью характерна поверхностная кристаллизация, кристаллическая фаза растёт от границы раздела расплав–воздух. При малой вязкости расплава наблюдается объёмная кристаллизация.
Дата добавления: 2018-11-26; просмотров: 1414;











