Режимы процессов кристаллизации
Процесс роста кристаллической фазы включает следующие этапы:
1. Подвод частиц в расплаве к границе раздела кристалл-расплав. Механизм движения – диффузионный. Так как вязкость силикатного расплава велика, то толщина диффузионного слоя δ значительна.
2. Кинетический этап. Частицы из расплава встраиваются в решётку кристалла. Протекает кристаллохимическое взаимодействие ростовой частицы с границей раздела.
Скорость процесса, протекающего через последовательные этапы, лимитируется скоростью самого медленного этапа. Если скорость подвода частиц к границе раздела мала, то режим процесса кристаллизации диффузионный. Если скорость кристаллизации ограничена скоростью кристаллохимического акта, то режим кристаллизации кинетический.
Высокая вязкость силикатных расплавов ограничивает транспорт частиц. Для стёкол кристаллизация осуществляется по диффузионному режиму вследствие высокой вязкости расплава и низкой подвижности частиц (рис. 3.12).
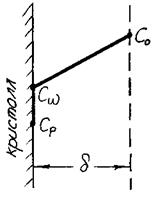
Рис. 3.12. Схема границы раздела
Со – концентрация компонента в объеме;
Сω – концентрация компонента на границе раздела;
Ср – равновесная концентрация компонента.
1. Первая стадия – диффузионный этап. Протекает диффузия компонентов к границе раздела. Скорость диффузионного процесса рассчитывается по разности концентраций на границах диффузионного слоя δ:
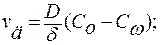
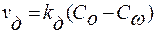 .
.
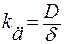 – константа скорости диффузии.
– константа скорости диффузии.
2. Вторая стадия – кинетический этап. Кинетический этап включает поверхностную диффузию и кристаллохимический акт (рис. 3.13). Считают, что встраивание ростовых частиц (кристаллохимический акт) протекает практически мгновенно, без затруднений и не лимитирует процесса кристаллизации.
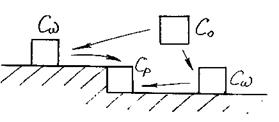
Рис. 3.13. Поверхностная диффузия ростовых частиц
на растущей грани к ступеньке роста кристалла
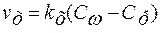 ;
; 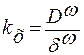 ,
,
где δω – эффективная толщина диффузионного слоя (среднее расстояние от адсорбированной частицы до ступеньки роста).
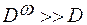 – коэффициент поверхностной диффузии намного больше коэффициента объёмной диффузии, адсорбированные частицы перемещаются гораздо быстрее объёмных.
– коэффициент поверхностной диффузии намного больше коэффициента объёмной диффузии, адсорбированные частицы перемещаются гораздо быстрее объёмных.
В установившемся режиме скорости последовательных этапов равны: v1= v2 или vд = vx. Рассчитаем скорость кристаллизации, исключив из уравнений промежуточную концентрацию Сω, т.к. обычно эту концентрацию трудно определить.
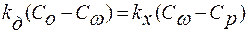 ;
;
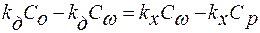 ;
;
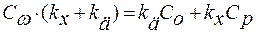 ;
;
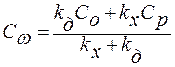 .
.
Выразим скорость реакции через скорость первого этапа:
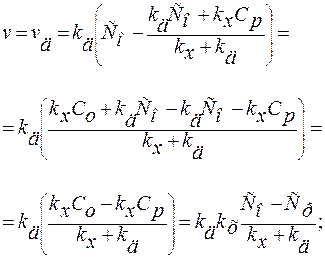
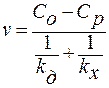 .
.
1) kд>>kx v=kx (Co–Cp) – режим кинетический;
2) kд<<kx v=kд (Co–Cp) – режим диффузионный.
Дата добавления: 2018-11-26; просмотров: 1361;











