Основы теории кристаллизации
ФАЗОВЫЕ ПРЕВРАЩЕНИЯ В СТЁКЛАХ
3.1. Кристаллизация в стёклах
Стеклообразное состояние при низких температурах нестабильно. При нагревании подвижность атомов возрастает, и стекло стремится перейти в термодинамически устойчивое состояние путём кристаллизации или ликвации. Самопроизвольная (неуправляемая) кристаллизация или ликвация приводит к потере прозрачности стёкол, нарушает технологические режимы выработки и формования. В технологии стекла кристаллизация является, как правило, нежелательным процессом. При производстве обычных стёкол её стараются избегать. Кристаллические включения образуются при нарушении технологических параметров охлаждения стекломассы. Основные меры борьбы с кристаллическими включениями – подбор составов стёкол, не склонных к кристаллизации, тщательная отработка технологических процессов, неукоснительное соблюдение технологических инструкций.
Тем не менее, кристаллизацию в ряде случаев организуют специально для усиления определённых свойств стёкол. Управляя процессами кристаллизации, удаётся получать разнообразные материалы на основе стекла.
1. Кристаллизация используется для получения непрозрачных стёкол молочно-белого цвета – матовых, опаловых и других. Для этого вводят фториды и соединения фосфора, которые при охлаждении вызывают образование мелких кристалликов, заглушающих стекло.
2. Кристаллизацию организуют для получения цветных стёкол, вводя соединения металлов – меди, золота и других. Металлы восстанавливаются и выделяются в виде кристалликов при специальной термообработке стекла (получают медный рубин, золотой рубин и др.).
3. Направленной кристаллизацией стёкол получают ситаллы – стеклокристаллические материалы с повышенными физико-химическими и эксплуатационными свойствами (высокой прочностью, химической устойчивостью и другими уникальными свойствами).
Основы теории кристаллизации
Наблюдения показывают, что новая фаза появляется не сразу во всём объёме исходной фазы. Сначала в отдельных участках материнской стекловидной фазы появляются мелкие зародыши дочерней фазы с упорядоченным расположением частиц. Со временем эти зародыши разрастаются в кристаллическую фазу, распространяющуюся по всему стекла. Теория появления зародышей была в общем виде сформулирована Гиббсом и затем детально разработана Фольмером, Френкелем и другими исследователями.
Во всякой системе, даже находящейся в состоянии термодинамического равновесия, наблюдаются уклонения различных интенсивных свойств от их средних значений.
Например, если Т – средняя температура, то имеются ограниченные локальные участки, где температура Т´ > T или T´´ < T.
ρ – средняя плотность, ρ´ > ρ или ρ´´ < ρ.
С – средняя концентрация, С´ > С или С´´< C.
Эти уклонения интенсивных свойств от их средних значений называются флуктуациями. Они возникают вследствие теплового движения атомов и ионов. Маленькие флуктуации появляются непрерывно, крупные – гораздо реже.
Если возникновение флуктуации не сопровождается появлением поверхности раздела, флуктуацию называют гомофазной. Если флуктуация отделяется от материнской фазы видимой границей раздела, флуктуацию называют гетерофазной.
Вероятность W появления флуктуаций обоих видов выражается уравнением:
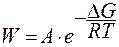 ,
,
А – предэкспоненциальный множитель;
ΔG – изменение энергии Гиббса системы при образовании флуктуации.
Изменение энергии Гиббса можно рассчитать, если известен объём флуктуации:
n = v/V,
n – число молей вещества во флуктуации;
v – объём данной флуктуации;
V – объём одного моля вещества.
Изменение энергии Гиббса при появлении гомофазной флуктуации составляет:
ΔG = n (G2 – G1),
G1 — молярная энергия Гиббса в исходной фазе;
G2 – молярная энергия Гиббса в новой дочерней фазе.
Если в стеклофазе появляется кристаллоподобная гомофазная флуктуация, то
ΔG = n (Gкр – Gст),
Gкр – молярная энергия Гиббса кристаллической фазы;
Gст – молярная энергия Гиббса стеклообразной фазы.
Последние два уравнения характеризуют изменение энергии Гиббса системы при возникновении гомофазной флуктуации. Если возникает гетерофазная флуктуация, то необходимо учитывать энергию межфазной границы:
ΔG = n (G2 – G1) + σ∙ω,
σ – свободная энергия единицы поверхности раздела фаз;
ω – площадь поверхности гетерофазной флуктуации.
Для зарождения новой фазы существенны гетерофазные флуктуации. Вероятность W возникновения зародышей определяется, в основном, изменением энергии Гиббса ΔG, т.к. предъэкспоненциальный множитель А мало изменяется при изменении внешних условий.
Допустим, что появляется шаровая гетерофазная флуктуация радиусом r. Её объём и поверхность легко рассчитать:
v = 4/3∙π r3; ω = 4πr2.
Молярный объём V выразим через массу моля вещества M и его плотность ρ: V = M/ρ. После подстановок уравнение для изменения энергии Гиббса примет вид:
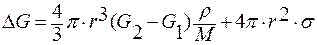 .
.
Рассмотрим, как изменяется ΔG при различных условиях. Возьмём в качестве меры пересыщения уклонение температуры системы от равновесной.
То – температура равновесного существования двух фаз. Для случая кристаллизации То = Тпл. Зависимость энергии Гиббса от температуры определяется уравнением:
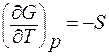 .
.
Так как энтропия S всегда положительна, то с повышением температуры энергия Гиббса G любого вещества уменьшается (рис.3.1.).
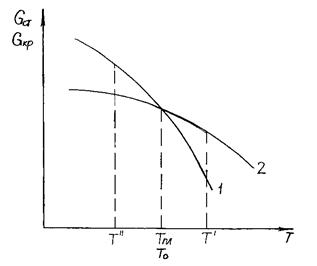
Введём обозначения: 1 – стекло, 2 — кристаллическая фаза.
Рис. 3.1. Изменение энергии Гиббса стекла и кристаллической фазы с температурой
T' > Tпл Gкр–Gст > 0
Т = Тпл Gкр = Gст
T'' > Tпл Gкр–Gст < 0
Знак первого слагаемого в выражении для ΔG зависит от температуры, а второе слагаемое 4πr2σ всегда положительно.
Т = То – ΔG ~ r2 .
Т' > То – с увеличением радиуса r растёт ΔG, причём рост более интенсивный, чем в первом случае, так как добавляется первое слагаемое, пропорциональное r3 (рис.3.2).
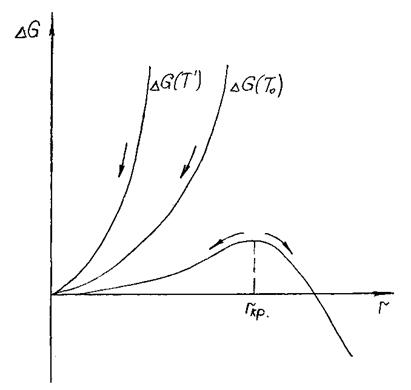
Рис. 3.2. Изменение энергии Гиббса системы с размером
флуктуации, появившейся при различных температурах
Новая фаза живуча, если увеличение её объёма сопровождается уменьшением энергии Гиббса. Если появится флуктуация любого размера r при Т' ≥ То , то её дальнейший рост (r ↑) сопровождается увеличением энергии Гиббса системы. При заданных Р и Т все процессы самопроизвольно могут протекать в сторону уменьшения энергии Гиббса G. Поэтому при Т' ≥ То самопроизвольно идёт распад гетерофазных флуктуаций, они исчезают (r ↓). Все флуктуации, появившиеся при температурах Т' ≥ То растворяются в исходной материнской фазе (r → 0).
При температуре T'' < Tпл первое слагаемое уравнения ΔG = ΔG (r) отрицательно.
G2 – G1 < 0; G2<G1.
Первое слагаемое уравнения ΔG = ΔG (r) растёт пропорционально r3, второе слагаемое растёт пропорционально r2. При малых радиусах превалирует квадратичная парабола, а при больших радиусах основной вклад в изменение ΔG вносит кубическая парабола – первое слагаемое, пропорциональное r3. Так как первое слагаемое имеет знак минус, а второе – плюс, то величина ΔG при увеличении размера флуктуации будет меняться, проходя через максимум.
Если размер флуктуации r < rкр, то самопроизвольный рост флуктуации невозможен, идет спонтанный распад флуктуации.
Если размер гетерофазной флуктуации r > rкр, то флуктуация самопроизвольно (спонтанно) растёт, увеличиваясь в размерах. Флуктуации с r > rкр являются зародышами новой фазы, так как они могут расти самопроизвольно.
Для выявления размера критической флуктуации найдем производную от ΔG по r и приравняет её к нулю.
При r = rкр производная 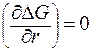 .
.
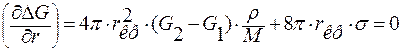
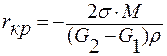 .
.
Выразим разность энергий Гиббса (G2 – G1) через параметры, доступные для измерения.
При Т = То G2(To) = G1(To);
Добавим и вычтем в разности (G2 – G1) одну и ту же величину:
G2(T) – G1(T) = [(G2(T) – G2(To)] – [G1(T) – G1(To)];
Воспользуемся уравнением:
f(x) = f(xo) + f΄(xср)∙(x – xo); f(x) – f(xo) = f΄(xср)∙(x – xo),
где f΄(xср) – производная в промежуточной точке xср между значениями x и xo: xср = (x – xo)/2.
Так как производная (dG/dT) = - S, то получим
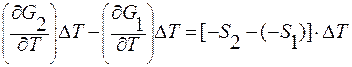 ;
;
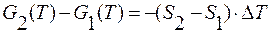 .
.
S2 – S1 = ΔS – изменение энтропии при переходе вещества в новую фазу.
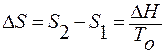 - при Т = const
- при Т = const
ΔH – тепловой эффект при переходе моля вещества из первой фазы во вторую.
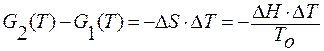 ;
;
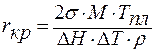 .
.
Большинство параметров этого уравнения являются физическими постоянными и входят в справочники. Из всех величин наибольшим изменениям могут быть подвергнуты два параметра: межфазное натяжение σ и переохлаждение ΔТ.
М/ρ – молярный объём, вполне определённая величина для данного вещества;
σ – сильно изменяется с введением поверхностно-активных веществ. Межфазное натяжение σ тем меньше, чем ближе состав и структура контактирующих фаз.
Если σ ↓, то rкр также уменьшается, повышается живучесть новой фазы.
Переохлаждение ΔТ может существенно влиять на rкр. Однако с уменьшением температуры растёт вязкость среды, что замедляет доставку вещества к растущему зародышу, а это затрудняет его формирование. Поэтому разность температур ΔТ влияет на зародышеобразование только до определённых пределов.
С изменением rкр существенно меняется работа образования зародыша критического размера.
Акр = –ΔFкр, ΔFкр – изменение свободой энергии Гельмгольца.
Строго говоря, Акр = –ΔFкр, но в конденсированных фазах ΔF ≈ ΔG. Поэтому можно найти работу образования критического зародыша, подставив в уравнение для ΔG вместо r критический радиус rкр:
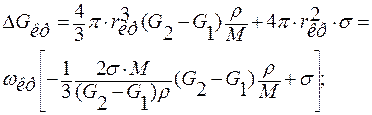
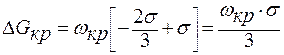 ;
;
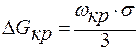 .
.
Работа образования критического зародыша составляет только 1/3 часть от работы образования его поверхности. Недостающие 2/3∙ΔGкр покрываются за счет внутренней энергии, за счёт перехода вещества в устойчивое состояние из нестабильной фазы. Так как Gкр<Gст, то вещество самопроизвольно переходит в фазу с меньшей энергией Гиббса.
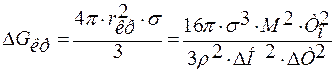 .
.
ΔGкр очень сильно зависит от межфазного натяжения σ и от переохлаждения ΔТ, так как имеем σ3 и ΔТ2.
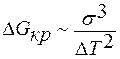 .
.
σ↓ ΔТ↑ rкр и ΔGкр ↓
Выведенные уравнения относятся к сферическим зародышам, однако качественно их можно применять и к появлению зародышей других форм. Влияние σ и ΔТ останется прежним, изменится только коэффициент формы или постоянные величины. Для критического зародыша кубической формы
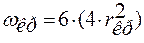 ,
,
где размер ребра куба принят равным 2r, множитель 6 – число граней кубического зародыша. Площадь поверхности куба составит ωкуб=24∙ r2, а для шара ωшар=12,48∙ r2.
Наиболее часто выведенные уравнения используются при анализе процессов образования кристаллических зародышей в жидкой фазе. Добавление небольших количеств поверхностно-активных веществ, снижающих σж-тв, позволяет уменьшить критический размер зародыша и работу его образования.
Дата добавления: 2018-11-26; просмотров: 1402;











