Механизм буферирующего действия
Рассмотрим ацетатный буфер. Концентрация ионов водорода определяется равновесием:
СН3СООН ↔ СН3СОО− + Н+,
которое за счет относительно большой концентрации СН3СОО− из соли, значительно сдвинуто влево. Если добавляются ионы водорода (кислота), то равновесие смещается еще больше влево и общая концентрация ионов Н+, остается примерно постоянной. С другой стороны, добавление гидроксил ионов (щелочи) приводит к смещению равновесия:
H+ + OH− ↔ H2O
вправо. Это уменьшает концентрацию ионов Н+, вызывая большую ионизацию молекул СН3СООН. Снова восстанавливается концентрация Н+ до начального значения.
При добавлении кислоты концентрация соли буфера уменьшается на столько, на сколько концентрация кислоты буфера возрастает. pH уменьшается на:
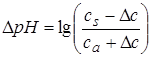 .
.
При добавлении щелочи концентрация соли буфера возрастает на столько, на сколько концентрация кислоты буфера уменьшается. pH увеличивается на:
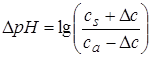 .
.
Щелочные буферные системы работают аналогично: добавляемая кислота взаимодействует с основанием буфера с образованием соли (cb↓, cs↑), добавляемая щелочь взаимодействует с солью буфера с образованием основания (cb↑, cs↓).
Буферное действие растворов индивидуальных солей объясняется возникновением в результате гидролиза кислот и оснований, например,
Na2B4O7 + 2H2O ↔ 2NaOH + H2B4O7.
Буферная емкость
Очевидно, что способность буферного раствора сохранять pH не может быть беспредельна. С увеличением объема и концентрации приливаемой кислоты или щелочи pH системы все же изменяется: сначала незаметно, с каждой приливаемой порцией все больше и больше. Для оценки буферирующих свойств растворов используют величину, называемую буферная емкость B − число молей эквивалентов кислоты или щелочи nэ, которые надо добавить к 1 литру буфера для изменения pH на единицу:
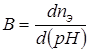 .
.
Буферная емкость зависит от природы раствора, концентраций (и их соотношения) компонентов. Наибольшая B наблюдается для растворов с максимально возможной концентрацией и при условии равенства концентраций сопряженных кислоты и основания, например, соли и кислоты ацетатного буфера cs=ca или соли и основания аммиачного буфера cs=cb.
Дата добавления: 2022-02-05; просмотров: 527;











