Константа гидролиза, степень гидролиза
Константу гидролиза Kh и степень гидролиза 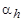 используют для количественной оценки гидролиза. Степень гидролиза – доля гидролизованных молекул: отношение концентрации (числа) гидролизованных Ch к начальной концентрации (числу) молекул С0. По смыслу это аналогично понятиям степень диссоциации, ионизации, превращения
используют для количественной оценки гидролиза. Степень гидролиза – доля гидролизованных молекул: отношение концентрации (числа) гидролизованных Ch к начальной концентрации (числу) молекул С0. По смыслу это аналогично понятиям степень диссоциации, ионизации, превращения
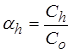 .
.
Рассмотрим случай гидролиза по аниону.
KCN +HOH ↔ HCN + KOH или в ионном виде
СN¯ + HOH ↔ HCN + OH¯
Константа химической реакции для этого процесса
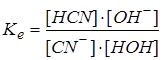 .
.
В разбавленных растворах вода находится в большом избытке, ее концентрация практически не меняется при смещении равновесия гидролиза и, как постоянную величину, [HOH] объединяют с Ke в константу, называемую константой гидролиза Kh:
Kh = Ke · [HOH] = 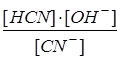 .
.
Умножив числитель и знаменатель на [H+], получим:
Kh = 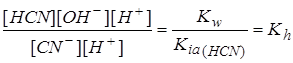 , где
, где
Kw – ионное произведение воды, Kia(HCN) – константа ионизации слабой (синильной) кислоты.
Концентрация гидролизованных мол-л C0 .αh, а негидролизованных
С0 -C0 .αh = C0(1-αh). Тогда для электролита типа (1-1):
Kh = 
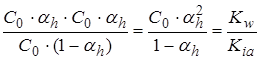 .
.
Если в знаменателе можно пренебречь αh по сравнению с единицей, то:
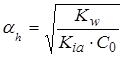 .
.
Можно оценить pH раствора:
[OH–] = Co.αh = 
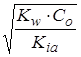 ; [H+] =
; [H+] = 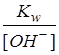 =
= 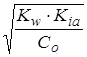 ;
;
pH = -lg[H+] = -lg 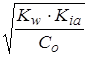 .
.
Например, для 0,1 М раствора KCN, зная, что Kia (HCN)= 4,9·10-10,
pH=-lg 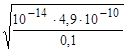 = 11,2 – сильно щелочной раствор.
= 11,2 – сильно щелочной раствор.
Аналогично рассуждая, можно вывести формулы для расчета Kh , αh, pH для других типов гидролизующихся солей.
Гидролиз по катиону (NH4Cl):
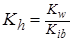 ,
, 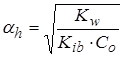 , pH =
, pH = 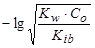 ,
,
где Kib – константа ионизации слабого основания. Например, для 0,1 М раствора NH4Cl, зная, что 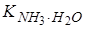 = 1,77·10-5 , получим значения
= 1,77·10-5 , получим значения
Kh= 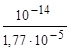 =5,65ּ10-10; αh=
=5,65ּ10-10; αh= 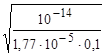 =7,52ּ10-5;
=7,52ּ10-5; 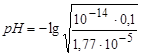 =
=
=5,12 – слабокислая среда.
Гидролиз по катиону и аниону (NH4CH3COO):
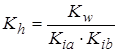 ;
; 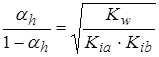 ,
,
где 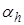 - значительная величина и ею нельзя пренебрегать по сравнению с единицей.
- значительная величина и ею нельзя пренебрегать по сравнению с единицей.
Гидролиз солей, образованных многоосновными кислотами или основаниями, протекающий в основном по первой ступени, описывается более сложными выражениями.
Дата добавления: 2022-02-05; просмотров: 694;











