Влияние состава раствора на растворимость
Рассмотрим растворимость AgCl:
В чистой воде γ± можно принять равным единице, так как концентрация ионов мала; n=m=1:
SP=11∙11∙S2∙11/2, 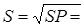 [Ag+] = [Cl−].
[Ag+] = [Cl−].
В растворе, содержащем одноименные с солью хлорид анионы Cl−, например, из KCl, растворимость определяется концентрацией ионов серебра, а γ± отличен от 1 за счет сильного электролита KCl:
SP=[Ag+]∙[Cl−]∙ 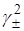 = S∙[Cl−]∙
= S∙[Cl−]∙ 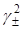 .
. 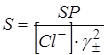 .
.
В растворе, содержащем посторонние ионы, например, из KNO3, растворимость отождествляется с концентрацией ионов Ag+ или Cl−, а γ± отличен от 1 за счет сильного электролита KNO3:
SP=[Ag+]∙[Cl−]∙ 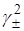 = S2 ∙
= S2 ∙ 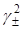 .
. 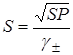 .
.
Расчеты показывают, что растворимость малорастворимого соединения незначительно повышается при введении постороннего электролита и резко (на несколько порядков) уменьшается при введении электролита, имеющего одноименные ионы. Это используется на практике для достижения полноты осаждения отделяемых ионов при систематическом анализе, когда берут некоторый избыток реагента, например, HCl при осаждении катионов первой аналитической группы в виде хлоридов, H2SO4 при осаждении катионов второй группы в виде сульфатов и т.д.
Превращение одних малорастворимых электролитов в другие
В практике качественного анализа часто приходится превращать одни осадки в другие. Сущность происходящего можно объяснить, используя понятие «произведение растворимости» (SP).
Если к системе, состоящей из насыщенного раствора Ag2CrO4 и кирпично-красного осадка Ag2CrO4 прилить избыток раствора KCl и содержимое встряхнуть, то наблюдается изменение цвета осадка за счет образования белого творожистого AgCl:
Ag2CrO4 + 2Cl– → 2AgCl↓ + CrO42–.
кирпично-красный, тв. белый, тв.
Это происходит потому, что растворимость хлорида много меньше растворимости хромата SAgCl << S 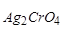 . В насыщенном растворе Ag2CrO4 концентрация Ag+ достаточна, чтобы превысить SPAgCl. Образование осадка AgCl уменьшает [Ag+] в растворе, и он становится ненасыщенным относительно Ag2CrO4, что приводит к его растворению. При избытке KCl весь осадок хромата серебра можно перевести в хлорид серебра. Сказанное подтвердим расчетом [Ag+] в насыщенном растворе AgCl и Ag2CrO4:
. В насыщенном растворе Ag2CrO4 концентрация Ag+ достаточна, чтобы превысить SPAgCl. Образование осадка AgCl уменьшает [Ag+] в растворе, и он становится ненасыщенным относительно Ag2CrO4, что приводит к его растворению. При избытке KCl весь осадок хромата серебра можно перевести в хлорид серебра. Сказанное подтвердим расчетом [Ag+] в насыщенном растворе AgCl и Ag2CrO4:
- SPAgCl = 1,73ּ10-10 (моль/л)2 = [Ag+]ּ[Cl–], откуда [Ag+] = SAgCl = 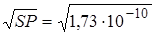 = 1,32ּ10-5моль/л;
= 1,32ּ10-5моль/л;
- SP 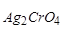 = 4,7ּ10-12 (моль/л)3 = [Ag+]2 ּ[СrO42–] = 22 . S3 = 4S3, откуда S
= 4,7ּ10-12 (моль/л)3 = [Ag+]2 ּ[СrO42–] = 22 . S3 = 4S3, откуда S 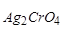 = [CrO42–] =
= [CrO42–] = 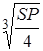 =
= 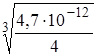 = 1,055 . 10-4 моль/л. [Ag+] = 2S = 2,11ּ10-4 моль/л.
= 1,055 . 10-4 моль/л. [Ag+] = 2S = 2,11ּ10-4 моль/л.
Аналогично нерастворимые ни в кислотах, ни в щелочах сульфаты Ва, Sr и Ca переводят в карбонаты, легко растворимые даже в уксусной кислоте:
СaSO4 + Na2CO3 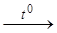 CaCO3↓ + Na2SO4 .
CaCO3↓ + Na2SO4 .
твердый конц. р-р
Реакция идет практически до конца, так как SP 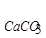 << SP
<< SP 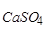 (3,7ּ10-9 << 1,7ּ10-5).
(3,7ּ10-9 << 1,7ּ10-5).
Следует отметить, что обратный переход превращения менее растворимых в более растворимые затруднен, а при большой разнице в SP (~ 106) вообще не идет, например, переход AgI → AgCl (SAgI = 8,1ּ10-17, SAgCl = 1,73ּ10-10).
Вопросы
1. Чем химические методы анализа отличаются от инструментальных?
2. В чем заключается условность понятия «степень окисления» атома элемента?
3. Какие аналитические реакции называются «сухими»?
4. На чем основано отнесение иона к той или иной аналитической группе?
5. Какие ионы открывают дробным анализом и при систематическом ходе анализа?
6. В каком виде отделяют амфотерные катионы при кислотно-щелочной системе?
7. Общие и отличительные реакции галогенид-анионов.
8. Сформулировать закон действующих масс.
9. Чем химическое равновесие отличается от механического?
10. Способы изменения равновесного состояния.
11. Какие проводники относят к электролитам?
12. Как степень ионизации молекул вещества зависит от его концентрации?
13. Связь общей константы ионизации многоосновной кислоты с константами отдельных ступеней.
14. Как подавить гидролиз соли слабого основания?
15. Расчет рН раствора соли, подвергающейся гидролизу.
16. Основные положения протолитической теории кислот и оснований.
17. Какие смеси обладают буферирующим свойством?
18. Анализ уравнения Henderson-Hasselbalсh.
19. Суть буферирующего действия на примере системы НСООН+НСООNa.
20. Связь растворимости малорастворимого соединения и его произведения растворимостей.
21. Как нерастворимый в кислотах ВаSО4 перевести в раствор?
Дата добавления: 2022-02-05; просмотров: 617;











