Ионное произведение воды
Вода – слабый электролит. Ее ионизация
Н2О ↔ ОН− + Н+
описывается константой
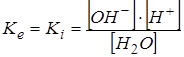 .
.
Концентрация непроионизировавших (непродиссоциировавших) молекул воды практически не меняется при смещении равновесия, поэтому как постоянную величину ее можно объединить в виде произведения с Ki в новую константу Kw, называемую ионное произведение воды
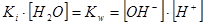 .
.
Kw не зависит от концентрации ионов ОН− или Н+. Их произведение при данной температуре есть величина постоянная, например, при 298 К Kw=1,008·10−14 (моль/л)2. Более удобно пользоваться величиной, полученной после логарифмирования, обозначив действие оператором pX=−lgX:
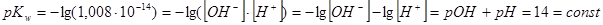
При равновесии [ОН−] = [Н+] = 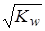 = 10−7 моль/л, поэтому pOH = pH = 7 для нейтрального раствора. В кислом растворе [ОН−] < [Н+] и pH < 7 (например, pH = 3, pOH = 14–3 = 11). В щелочном растворе [ОН−] > [Н+] и pH > 7 (например, pH = 9, pOH = 14–9 = 5).
= 10−7 моль/л, поэтому pOH = pH = 7 для нейтрального раствора. В кислом растворе [ОН−] < [Н+] и pH < 7 (например, pH = 3, pOH = 14–3 = 11). В щелочном растворе [ОН−] > [Н+] и pH > 7 (например, pH = 9, pOH = 14–9 = 5).
Процесс ионизации воды сопровождается поглощением энергии в форме теплоты (∆Hi>0), поэтому при увеличении температуры Kw возрастает. Например, при 100о С pKw=12,23, то есть почти в 100 раз больше, чем при 25о С.
Гидролиз солей
Чистая вода имеет нейтральную реакцию, так как при ее ионизации:
HOH ↔ H+ + OH─
концентрации ионов H+ и OH– равны.
Опыт показывает, что водные растворы средних солей имеют кислую, щелочную или нейтральную реакции, хотя их молекулы не содержат ни ионов Н+, ни ионов ОН–. Это объясняется обратимым взаимодействием ионов соли с молекулами воды, сопровождающимся нарушением равновесия ионизации воды (изменением рН раствора), которое называется гидролизом соли. При этом образуется слабый электролит.
Гидролизу подвергаются соли, образованные при взаимодействии:
- слабой кислоты и сильного основания (CH3COONa);
- слабого основания и сильной кислоты (NH4Cl);
- слабой кислоты и слабого основания (CH3COONH4).
Рассмотрим первый случай.
Ацетат натрия CH3COONa в воде полностью диссоциирует на ионы, т.к. является сильным электролитом. Ионное уравнение гидролиза:
CH3COO–+ Na+ + HOH ↔ CH3COOH + Na+ + OH–
показывает, что образуется уксусная кислота ‑ слабый электролит, то есть ионы H+ связываются ионами CH3COO–. Ионов OH– в р-ре становится больше, чем Н+ ‑ р-р имеет щелочную реакцию (pH>7). Говорят, что имеет место гидролиз по аниону.
Во втором случае раствор NH4Cl имеет кислую реакцию (pH<7), т.к. ионы OH– связываются катионами NH4+ с образованием слабого электролита NH3·H2O. Это пример гидролиза по катиону, при котором концентрация Н+ становится больше, чем концентрация гидроксил ионов.
В третьем случае происходит гидролиз и по катиону, и по аниону. Значение pH раствора зависит от соотношения сил слабой кислоты и слабого основания.
Хлорид натрия NaCl не подвергается гидролизу, раствор имеет нейтральную реакцию (pH=7), ионы H+ и OH– не связываются, так как NaOH и HCl– сильные электролиты.
Na+ + Cl– + HOH ↔ Na+ + OH– + H+ + Cl–.
Дата добавления: 2022-02-05; просмотров: 937;











