Растворимость. Произведение растворимости
Равновесие в системе, состоящей из двух и более фаз, называется гетерогенным. Если одной фазой системы является твердое малорастворимое вещество, например, соль CnAm, а другой фазой – насыщенный жидкий водный раствор ее, то в системе устанавливается равновесие:
СnAm(тв) ↔ nCm+(р-р) + mAn−(р-р) ,
где n – число катионов Cm+ с зарядом m+; m – число анионов An− с зарядом n−.
Для этого процесса константа химического равновесия имеет выражение:
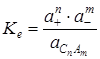 ,
,
где a− активности катиона (+) и аниона (−) в растворе и твердой соли. Так как активность индивидуального твердого вещества равна единице (или постоянна при T=const), то ее можно объединить с Ke, а новую постоянную называют произведением активностей или произведением растворимости SP:
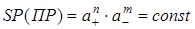 .
.
SP зависит от природы вещества и температуры, но не зависит от активности ионов этого вещества.
Связь растворимости S с произведением растворимости SP
Растворимостьюназывают явление, способность, образование относительно однородной смеси двух и более компонентов. Под растворимостью также понимают концентрацию насыщенного раствора. До сих пор используются Таблицы растворимости, в которых вещества условно разделены на растворимые (растворимость > 10 г/л обозначена буквой Р), малорастворимые (растворимость 0,01÷10 г/л обозначена буквой М) и нерастворимые (растворимость< 0,01 г/л обозначена буквой Н). Очевидно, что это более, чем формально, так как во многих случаях аналитики имеют дело с растворами, содержащими много меньше 00,1 г изучаемого объекта в литре.
Предполагаем, что ионизация (диссоциация) полная, тогда растворимость как концентрация насыщенного раствора S определяет концентрацию и активности ионов в нем. Представим активность в виде произведения концентрации ионов с на коэффициент активности γ и учтем, что концентрации катионов и анионов в n и m раз больше растворимости S
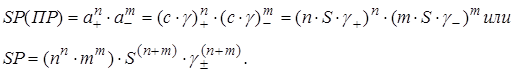
В формулу введен среднеионный коэффициент активности в виде:
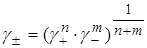 .
.
Именно γ±, а не коэффициенты активности отдельных ионов можно определить экспериментально или рассчитать.
Дата добавления: 2022-02-05; просмотров: 654;











