Изменение равновесного состояния
Равновесное состояние может быть целенаправленно изменено варьированием температуры (1) и состава реакционной смеси (2).
(1) Для количественного осаждения свинца в виде PbI2 реакцию:
Pb2+ + 2I− ↔ PbI2↓
проводят при пониженной температуре, так как этот процесс экзотермический (ΔH < 0): уменьшение Т смещает равновесие вправо.
(2) Рассмотрим реакцию:
H2O + CO ↔ H2 + CO2.
При температуре ~ 850о C константа равновесия ее равна единице:
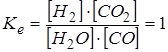 .
.
Пусть смешали по 2 моля H2O и CO. В равновесной смеси появятся H2 и CO2 по x моль, на столько же (по уравнению) уменьшится количество H2O и CO:
Вещества H2O CO H2 CO2
Исходный состав (моль) 2 2 0 0
Равновесный состав (моль) 2-x 2-x x x.
Решив уравнение:
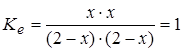
относительно x, получим состав равновесной смеси: по 1 молю всех участников (x=1). Если теперь увеличить количество H2O на 1 моль, то новое равновесное состояние будет отличаться от предыдущего тем, что количество H2 и CO2 возрастет до 1,2 моль, а CO уменьшится до 0,8.
Вещества H2O CO H2 CO2
Равновесный состав (моль) 1 1 1 1
Исходный состав (моль) 2 1 1 1
Равновесный состав (моль) 2-x 1-x 1+x 1+x.
Решив уравнение:
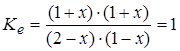
относительно x, получим состав:
Вещества H2O CO H2 CO2
Равновесный состав (моль) 1,8 0,8 1,2 1,2.
Следовательно, при добавлении воды степень превращения CO и выход продуктов увеличился – равновесие сместилось вправо. Того же результата можно достичь, если уменьшить количество любого продукта реакции. Очевидно, что обратные действия приведут к смещению равновесия влево.
Для смещения равновесия в прямом направлении необходимо использовать избыток исходных веществ и удалить продукты из зоны реакции (осаждением, выпариванием, дистилляцией, экстракцией, сорбцией). Для подавления реакции обычно в реакционную смесь добавляют продукты.
Равновесия в растворах электролитов
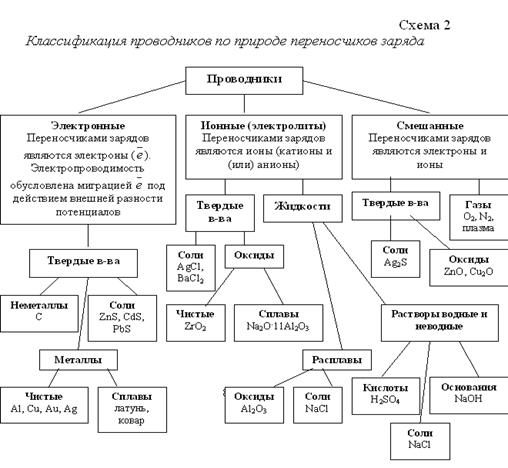
Проводниками будем называть вещества (материалы, смеси и т.д.), способные проводить электрический ток. В зависимости от природы частиц, переносящих электрический заряд, проводники можно разделить на электронные, ионные и со смешанной проводимостью (без учета дырочной), что показано на схеме 2 с некоторыми примерами.
В дальнейшем будем рассматривать лишь водные растворы кислот, оснований и солей.
Теория Аррениуса
Объяснение некоторых особенностей свойств растворов электролитов от неэлектролитов было дано Аррениусом. Оно касалось в первую очередь коллигативных свойств: понижения давления пара над раствором компонента по сравнению с давлением над чистыми веществами; повышения температуры кипения и понижения температуры замерзания раствора по сравнению с растворителем; осмотическое давление.
Положения теории Аррениуса (теории для слабых электролитов) следующие:
1. При растворении в воде молекулы веществ распадаются (диссоциируют, ионизируют) на заряженные частицы: положительные катионы (С) и отрицательные анионы (A):
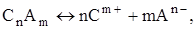
где n и m – число катионов и анионов соответственно; m+ и n– ‑ их зарядовые числа (“заряды”).
Ионизация не связана с прохождением электрического тока через раствор.
2. Диссоциируют не все молекулы; часть их остается нераспавшимися. Степень диссоциации (ионизации) αi характеризует долю (или процент) распавшихся молекул:
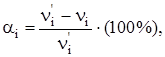
где 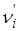 ‑ число молекул (молей) i-го вещества “до” ионизации;
‑ число молекул (молей) i-го вещества “до” ионизации;
νi – равновесное число молекул (молей) i-го вещества “после” ионизации.
3. Между нераспавшимися молекулами и ионами устанавливается динамическое
ческое равновесие, которое можно описывать, как химическое равновесие, константой равновесия, называемой константой электролитической диссоциации (ионизации).
Выражение для концентрационной константы ионизации:
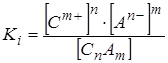 .
.
Степень ионизации, константа ионизации
Степень ионизации αi изменяется от 0 (для неэлектролитов) до 1
0  αi
αi  1 (100%).
1 (100%).
Это зависит от природы вещества, природы растворителя, концентрации и температуры.
При умеренных концентрациях (~ 0,1÷1,0 М) по значению αi все электролиты делят на сильные и слабые.
Для водных растворов к сильным электролитам (αi близка к единице) относят:
- сильные кислоты (HCl, HNO3, H2SO4),
- сильные основания (NaOH, KOH),
- большинство солей (NaCl, BaSO4, Cu(NO3)2, NaCH3COO).
К слабым электролитам (αi много меньше единицы, ~ 0,01) относят:
- слабые минеральные и органические кислоты (HCN, Н2СО3, H2S, CH3COOH, H2C2O4·2H2O),
- слабые минеральные и органические основания (NH3·H2O, CH3NH2·H2O, C6H5NH2·H2O),
- некоторые соли (HgCl2, Hg(CN)2, Fe(SCN)3, CdI2).
Дата добавления: 2022-02-05; просмотров: 447;











