Константа химического равновесия
Количественно равновесное состояние описывается константой химического равновесия Ke:
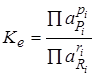
как отношение произведения равновесных активностей продуктов реакции к произведению активностей исходных веществ в степенях, равных стехиометрическим коэффициентам. В термодинамическую константу входят активности участников реакции. Так как равновесное количество может быть выражено и в других единицах (концентрациях, молях, мольных долях и т.д.), то используют и другие константы химического равновесия, например, концентрационная содержит равновесные концентрации с:
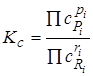 .
.
Например, для реакции:
N2 + 3H2 ↔ 2NH3
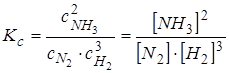 . В этом выражении формулы веществ в квадратных скобках символизируют молярные концентрации этих веществ: сi≡[i].
. В этом выражении формулы веществ в квадратных скобках символизируют молярные концентрации этих веществ: сi≡[i].
Свойства константы равновесия.
- Величина положительная: 0 < K < ∞. Чем больше Ke, тем более равновесие сдвинуто в правую сторону, в сторону продуктов реакции; чем меньше Ke, тем больше равновесие сдвинуто в сторону исходных веществ для данной записи.
2. Ke зависит от природы реакции и от температуры: для эндотермических реакций (ΔН > 0) увеличение Т смещает равновесие вправо, для экзотермических (ΔН < 0) − влево.
3. Kc не зависит от концентрации участников реакции: изменение концентрации одного из них приводит к изменению концентраций всех веществ так, что соотношение не меняется.
4. Для реакций, записанных наоборот, константы равновесия относятся как обратные величины:
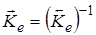 .
.
5. Ke связана со стандартным изменением энергии Гиббса ΔGо в ходе протекания реакции:
ΔG0 = − RTlnKe,
где R – универсальная газовая постоянная (8,31 Дж/моль·К);
T – температура в абсолютной шкале (о С+273) К.
6. Катализатор не влияет на Ke, изменяя лишь время достижения равновесия.
Дата добавления: 2022-02-05; просмотров: 481;











