Химическое равновесие – это такое состояние обратимого процесса
∑riRi ↔∑piPi
(r,pi – стехиометрические коэффициенты, Ri, Pi – исходные вещества и продукты реакции соответственно для данной записи), при котором:
- скорость прямой реакции равна скорости обратной реакции, 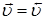 ;
;
- сохраняются неизменными во времени активности (концентрации, парциальные давления) всех участников реакции в каждой точке реакционного пространства, 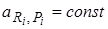 ;
;
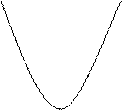
- энергия Гиббса системы минимальна, а энтропия – максимальна, 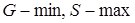 .
.
- изменения энергии Гиббса и энтропии равны нулю, 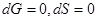 , при этом
, при этом 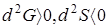 .
.


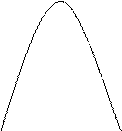 G S
G S
 |  |
Состояние системы Состояние системы
Химическое равновесие характеризуется:
- динамичностью, т.е. в условиях равновесия реакции не прекращаются, а протекают как в прямом, так и в обратном направлении с одинаковыми скоростями;
- подвижностью, т.е. равновесие смещается в ту или иную сторону при изменении внешних условий и восстанавливается при возвращении условий к начальным;
- возможностью достижения равновесного состояния как «слева» со стороны исходных веществ, так и «справа» со стороны продуктов реакции, например, в равновесной смеси будут присутствовать йодид водорода, водород и йод, если в сосуд поместить только HI или только H2 и I2, то есть
2HI ↔ H2 + I2 или H2 + I2 ↔ 2HI.
Признаками химического равновесия являются неизменность состава реакционной смеси (необходимый) и подвижность системы (достаточный).
Дата добавления: 2022-02-05; просмотров: 442;











