Закон разбавления Оствальда
Рассмотрим ионизацию простейшего электролита, молекула которого состоит из одного катиона (С) и одного аниона (А). Пусть его степень ионизации αi, концентрация c:
CA ↔ C+ + A–.
При равновесии концентрации катионов и анионов равны с·αi, а недиссоциированных молекул с-с αi= с(1-αi), тогда выражение для константы ионизации Ki:
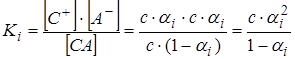 или
или 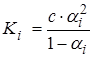 .
.
Если в знаменателе можно пренебречь αi по сравнению с единицей, то получим:
Ki = с·αi2.
Так как по определению Ki есть величина постоянная, не зависящая от концентрации, увеличение с приводит к уменьшению αi и наоборот. В предельно разбавленном растворе (с→0) степень ионизации стремится к единице.
Понятия степень ионизации и константа ионизации применяются в основном к растворам слабых электролитов. Однако и для сильных электролитов αi как эффективная степень ионизации при концентрации с определяется в виде отношения:
α с = 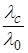 ,
,
где λс – эквивалентная электропроводимость раствора при концентрации с;
λ0 − эквивалентная электропроводимость предельно разбавленного раствора, то есть при концентрации, стремящейся к нулю.
Константа ионизации (диссоциации – менее предпочтительное, устаревающее название) зависит от природы растворенного вещества и растворителя, от температуры. По значению Ki можно судить о силе слабого электролита, например, сила кислот уменьшается в ряду муравьиная > уксусная > фенол симбатно с уменьшением Ki:
HCOOH − 1,77·10-4; CH3COOH − 1,75·10-5; C6H5OH – 1,01·10-10.
Многоосновные кислоты и основания ионизируют ступенчато, причем константа ионизации следующей ступени, как правило, меньше предыдущей, например, для лимонной кислоты:
1 ступень C6H8O7 ↔ H+ + C6H7O7− , K1 = 7,45·10-4 ,
2 ступень C6H7O7 ↔ H+ + C6H6O72− , K2 = 1,73·10-5 ,
3 ступень C6H6O7 ↔ H+ + C6H5O73− , K3 = 4,02·10-6 .
Общая константа ионизации равна произведению констант отдельных ступеней
K = ∏Ki = K1·K2·K3·….
Дата добавления: 2022-02-05; просмотров: 530;











