Окислительно-восстановительные реакции
Окисление (отдача)
Восстановление (присоединение)
Типичные окислители: 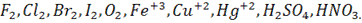
Типичные восстановители: K, Li, Na, Ca, Mg, Zn, Al, Fe, HCl, 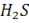 .
.
Электрохимический процесс – процесс превращения химической и электрической энергии.
Электролиз – процесс превращения электрической энергии в химическую энергию.
Гальванический элемент (хим. энергия →электрическая энергия) – устройство, в котором хим. энергия ОВР превращается в электрическую.
Наиболее распространенным является гальванический элемент, состоящий из двух электродов, представляющих собой металлические пластины, погруженные в раствор электролита.
(-)…│…р-ор││р-ор│… (+)
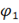
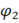
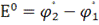
Уравнение Нернста
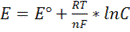 , где
, где
n – число принятых или отданных электронов
F - число Фарадея (≈96500 Кл/моль)
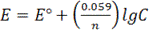
Пример. Определить ЭДС элемента, в котором протекает реакция
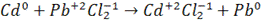
при 298 К, если концентрация раствора 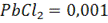 , а раствора
, а раствора 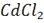 =0,005.
=0,005.
1)Составить гальваническую схему, найти ЭДС и константу равновесия



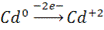 2
2
 2
2
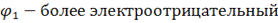
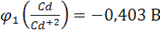
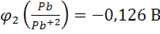
(-)Cd│ 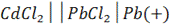
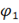
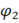
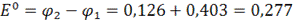 В
В
Е = 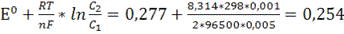 В
В
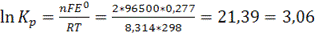
Электролиз-это окислительно-восстановительный процесс, который протекает на электродах при прохождении постоянного эл. тока через растворы или расплавы электролитов.
При электролизе протекает 2 параллельных процесса: на катоде (процесс восстановления) и на аноде (процесс окисления). На характер и течение электродных процессов при электролизе, большое влияние оказывают состав электролита, растворитель, материал электродов и режим электролиза (напряжение, плотность тока, температура). Прежде всего надо различать электролиз расплавленных электролитов и растворов.
Дата добавления: 2019-12-09; просмотров: 849;











