Лекция №12-13 Раздел 4. Фазовые равновесия
Одно и то же вещество при изменении Т и Р может изменять агрегатное состояние без изменения химического состава. Это явление называется фазовым переходом.
В гетерогенной системе, где нет химических воздействий, но есть фазовые переходы, при Р, Т = const существует фазовое равновесие, характеризующееся некоторым числом фаз, компонентов и числом степеней термодинамической свободы системы.
Фаза – однородная часть системы, отделенная от других частей видимыми поверхностями раздела, обладающая одинаковым составом, физическими и химическими свойствами и которая может быть удалена из системы механическим путем.
Пример: «лед+вода» – 2 фазы; «соль+насыщенный раствор+ пар» – 3 фазы. Газообразная фаза может быть лишь одна, жидких – 2–3, твердых – сколько угодно.
Компонент– химически однородная часть системы, которая может быть выделена из системы и существовать вне ее. Пример: в водном растворе NaCl компоненты – это вода и соль, но не Na+ и Cl– , т.к. ионы не существуют как отдельные вещества.
Число степеней свободы – число параметров системы, которые могут быть изменены в некоторых пределах без изменения числа и природы фаз в системе.
Пример: у системы, состоящей только из газа, можно менять 2 параметра, т.к. третий определяется из уравнения состояния (т.е. его система устанавливает самопроизвольно).
Правило фазрегулирует число степеней. Это правило установил Джозайя Уиллард Гиббс (амер. физик и ф/х) в 1876: число степеней равновесной ТД-системы, на которую из внешних факторов влияют только Т и Р, равно числу независимых компонентов системы (К) минус число фаз (Ф) плюс два: С=К–Ф+2, причем С не может быть отрицательным. Если один из параметров постоянен, то 2 заменяется на 1.
Системы классифицируют по числу фаз (одно-, двухфазные), компонентов (одно-, двухкомпонентные) и числу степеней свободы (инвариантные, моновариантные, дивариантные и т.д.).
Однокомпонентная (К=1) гетерогенная система: С = 1– Ф +2 = 3 – Ф; максимальное число равновесных фаз не может быть >3, т.к. всегда С>0.
· одна фаза: С=2, т.е. без нарушения равновесия здесь можно менять 2 параметра – Т и Р.
· две фазы: С=1, без нарушения равновесия можно менять только 1 параметр – Т или Р.
· три фазы: С= 0, равновесию соответствуют жестко фиксированные значения Р и Т.
Графическая зависимость состояния системы от внешних условий называется фазовой диаграммой или Р, Т-диаграммой.
Фазовая диаграмма воды содержит области, кривые и тройную точку. Проанализируем ее с позиции правила фаз.
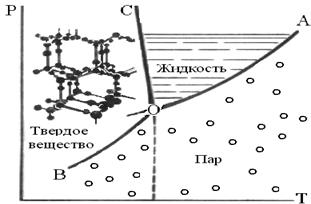
Рисунок 5. Фазовая диаграмма воды
Вода – единственное вещество, присутствующее в системе (К=1) и может существовать в 3-х фазах: твердой (область ВОС), жидкой (АОС) и газообразной (АОВ). Число фаз зависит от Т и Р.
Кривая ОА – зависимость насыщенного пара воды от Т. Вдоль этой линии при всех температурах от 0 до Т вода и пар находятся в равновесии друг с другом. ОВ – кривая сублимации льда. Во всех точках на кривой ОВ – равновесие «лед-пар», это кривая зависимости Р от Т.
Вдоль кривой ОВ «твердое вещество/пар», как и вдоль кривой ОА «жидкость/пар», при любом значении Т давление пара может иметь только одно значение, а при любом давлении пара для льда может существовать только одна Тпл (кривая ОС).
Выше этой линии вода существует в виде льда, а ниже – в виде пара. Кривая ОС описывает зависимость Тплавл. льда от Р, вдоль этой линии лед и жидкая вода находятся в равновесии. Наклон кривой ОС относительно оси ординат показывает, что при увеличении Р Тпл льда понижается.
Три кривые пересекаются в точке О (это «тройная точка»), соответствующей равновесию всех трех фаз. В тройной точке не существует степеней свободы; 3 фазы могут существовать в равновесии только при определенном значении Т и Р. Экспериментально найдено, что в этой точке Рпара= 6,1 кПа, Т=273,16 К.
Кривая сублимации ОВ теоретически продолжается до абсолютного нуля, а кривая давления пара ОА заканчивается при критической Т 607,46 К и давлении 19,5 мПа.
В верхней части кривой плавления ОС характерно появление различных новых кристаллических форм льда, плотность которых в отличие от обычного льда больше, чем у воды. Эти новые фазы на рисунке не показаны.
Внутри области (С=2) можно варьировать и Т, и Р без изменения числа фаз. На кривой (С=1), описывая систему, можно изменить либо Т, либо Р. Значения К, Ф и соответствующие степени свободы С в различных частях фазовой диаграммы воды приведены в таблице 4.
Таблица 4 - Степени свободы С в различных частях фазовой диаграммы воды
| Часть плоскости | К | Ф | С |
| Область | |||
| Кривая | |||
| Тройная точка |
Дата добавления: 2019-12-09; просмотров: 1237;











