МЕДНО-ЦИНКОВЫЙ ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
(ЭЛЕМЕНТ ДАНИЭЛЯ-ЯКОБИ)
Электрохимическая схема
Анод (–) Zn ½ ZnSO4 ½½ CuSO4 ½ Cu (+) Катод
E0Zn2+/Zn = – 0,76 B EoCu2+/Cu = +0,34 B
Электронные уравнения электродных процессов
Анод (–) Zno – 2 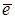 ® Zn2+ окисление
® Zn2+ окисление
Катод (+) Cu2+ +2 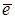 ® Cu0 восстановление
® Cu0 восстановление
Суммарная реакция
Zn + CuSO4 = ZnSO4 + Cu
ЭДС = ЕК – ЕА = ECu2+/Cu – EZn2+/Zn
Уравнение Нернста
EMen+/Me = E0Men+/Me + 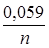 lg[Men+], где
lg[Men+], где
ЕMen+/Me – электродный потенциал металла,
EoMen+/Me – стандартный электродный потенциал металла,
n – заряд иона металла,
[Men+] – концентрация ионов металла в электролите.
ПРИНЦИП ДЕЙСТВИЯ СВИНЦОВОГО
КИСЛОТНОГО АККУМУЛЯТОРА
Электрохимическая схема
(–) Pb |H2SO4| PbO2 (+)
25–30%
Зарядка аккумулятора (электролиз)
K(–) PbSO4(тв) + 2 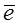 ® Pb(тв) + SO
® Pb(тв) + SO 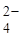 (водн)
(водн)
Pb2+ + 2 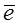 = Pb0 восстановление
= Pb0 восстановление
A(+) PbSO4(тв) + 2H2O(ж) – 2 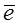 ® PbO2(тв) + 4H+(водн) +SO
® PbO2(тв) + 4H+(водн) +SO 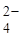 (водн)
(водн)
Pb2+ – 2 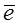 = Pb4+окисление
= Pb4+окисление
Разрядка аккумулятора (гальванический элемент)
A(+) Pb(тв) + SO 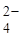 (водн) – 2
(водн) – 2 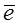 ® PbSO4(тв)
® PbSO4(тв)
Pb – 2 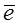 = Pb2+окисление
= Pb2+окисление
K(-) PbO2(тв) + 4H+(водн) + SO 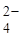 (водн) ++ 2
(водн) ++ 2 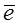 →PbSO4(тв) + 2Н2О(ж)
→PbSO4(тв) + 2Н2О(ж)
Pb4+ + 2 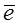 = Pb2+восстановление
= Pb2+восстановление
Общее уравнение реакции:
Pb + PbO2 + 2H2SO4 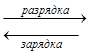 2PbSO4 + 2H2O
2PbSO4 + 2H2O
Дата добавления: 2019-12-09; просмотров: 1140;











