Гетерогенное (неравновесное) распределение микрокомпонента между твердой и жидкой фазами
Гетерогенное (неравновесное) распределение может быть достигнуто путем медленного испарения раствора, содержащего макро- и микрокомпоненты, при непрерывном его перемешивании.
Этот случай был впервые рассмотрен Г. Дернером и В. Хоскинсом, которые в своих теоретических выводах исходили из кинетических представлений о ионном обмене между поверхностью кристалла и раствором, развитых Ф. Панетом.
Представим себе очень медленно растущий кристалл бариевой соли, находящийся в ее насыщенном растворе, содержащем некоторое количество радия. В каждый данный момент роста между поверхностным слоем кристалла и раствором происходит ионный обмен, причем на поверхности кристалла наряду с ионами бария фиксируется также некоторое количество ионов радия, пропорциональное концентрации их в растворе. Если процесс роста происходит достаточно медленно для того, чтобы между поверхностным слоем и раствором успевало установиться равновесие, то к распределению радия (в отношении каждого элементарного слоя кристалла) может быть приложено уравнение Бертло — Нернста — Хлопина:
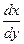 =
= 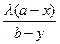 (5)
(5)
где dx — количество соли радия, перешедшей в элементарный слой кристаллов;
dy — количество соли бария, перешедшей в элементарный
слой кристаллов;
а и b — количества солей радия и бария в растворе в начале кристаллизации;
х и у — количества солей радия и бария, перешедших в данный момент кристаллизации в смешанный кристалл;
λ — постоянная кристаллизации.
После того как закончится образование первого элементарного слоя, начнет образовываться другой. Между новым элементарным слоем и раствором вновь установится истинное равновесие, так как обмен между отдельными слоями практически не происходит вследствие отсутствия диффузии и медленности процесса перекристаллизации. В этих, условиях распределение микрокомпонента (радия) в кристалле будет определяться прежде всего численным значением постоянной кристаллизации А,.
В том случае, когда λ= 1 (распределение изотопов), концентрация распределяющейся микропримеси будет одинакова для всех слоев, и мы получим однородный кристалл. В противном случае, когда λ ≠ 1, образующиеся кристаллы не будут однородными. Очевидно, что при λ > 1 концентрация микрокомпонента в поверхностном слое растущего кристалла будет максимальной в начале кристаллизации. Образующиеся в дальнейшем слои кристалла будут беднее микрокомпонентом, так как процесс кристаллизации приводит к постепенному обеднению им раствора/
Таким образом, при λ > 1 образуются слоистые кристаллы, содержание микрокомпонента в которых уменьшается в направлении от внутренних слоев к наружным.
Прямо противоположная картина распределения наблюдается в том случае, когда λ< 1. Нетрудно видеть, что получаемая при этом слоистая структура отличается от первой тем, что изменение концентрации микрокомпонента в элементарных слоях происходит в обратном направлении.
Неоднородность образующихся в этих случаях кристаллов может быть установлена с помощью радиографического исследования или измерения активности растворов, получающихся при фракционированном растворении кристаллов.
Интегрируя выражение (5) можно получить уравнение, описывающее распределение микрокомпонента между всем кристаллом и раствором в определенный момент кристаллизации.
1п 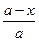 = ln
= ln 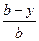 (6)
(6)
Таким образом, в противоположность ранее указанным трем путям изучения сокристаллизации, приводящим к гомогенному распределению, 4-й путь (медленное испарение насыщенного раствора при постоянной температуре и непрерывном перемешивании) приводит к гетерогенному распределению. При таком распределении логарифм .отношения количества (концентрации) микрокомпонента в растворе в данный момент к количеству его в начале кристаллизации, деленный на логарифм отношения количества макрокомпонента в данный момент к количеству его в начале кристаллизации, является постоянной величиной ( 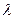 ).
).
Если уравнение (1), являющееся математическим выражением закона Хлопина, требует наличия истинного равновесия между выделившимися кристаллами и раствором, а также равномерного распределения микрокомпонента по всему объему кристалла, то формула Дернера и Хоскинса относится к случаю, когда истинное равновесие между кристаллами и раствором не существует (здесь мы имеем дело с термодинамически неустойчивым, как бы замороженным состоянием).
Дата добавления: 2021-10-28; просмотров: 601;











