Адсорбция полимеров из растворов на твердой поверхности
Взаимодействие макромолекулы с твердой поверхностью лежит в основе многих физико-химических процессов и явлений: гель-хроматографии полимеров, стабилизации коллоидов полимерами. Испытываемые молекулами внешние пространственные ограничения определяют структуру цепей в аморфных прослойках микрогетерогенных систем (наполненные полимеры, блок-сополимеры, аморфно-кристаллические полимеры). Эффекты адсорбции макромолекул определяют адгезию полимеров к различным субстратам, проявляются при взаимодействии биополимеров с поверхностями клеток. Нативная структура биополимеров образуется в результате адсорбции макромолекулы на самой себе (белковая глобула) или на комплементарной цепи (двойная спираль ДНК).
Особенностью адсорбции в полимерных системах является существование фазовых переходов различного рода. Важнейшим отличием адсорбции полимеров от адсорбции низкомолекулярных соединений является наличие порогового эффекта. Если значение энергии притяжения звена цепи к поверхности меньше критической энергии 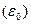 , требуемой для начала адсорбции
, требуемой для начала адсорбции 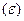
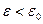 полимерные клубки остаются в растворе, доля связанного полимера
полимерные клубки остаются в растворе, доля связанного полимера 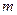 мала и не зависит от
мала и не зависит от 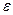 . При больших энергиях притяжения
. При больших энергиях притяжения 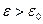 , все полимерные цепи связаны с поверхностью, доля свободных молекул в растворе (I - m ) - уменьшается до нуля с ростом
, все полимерные цепи связаны с поверхностью, доля свободных молекул в растворе (I - m ) - уменьшается до нуля с ростом 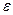 . С увеличением молекулярной массы при
. С увеличением молекулярной массы при 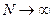 связывание молекул осуществляется скачкообразно:
связывание молекул осуществляется скачкообразно: 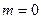 в докритической области и
в докритической области и 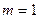 непосредственно при переходе через критическую точку
непосредственно при переходе через критическую точку 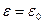 . При этом изменяется конформация цепей. В докритической области макромолекула представляет собой невозмущенный гауссов клубок. После адсорбции, при слабом покрытии поверхности, макромолекулы теряют свойства гауссовых клубков в направлении, перпендикулярном поверхности адсорбента и представляют собой последовательность адсорбированных участков и соединяющих их петель, средние размеры которых определяются величиной энергии сорбции. Переход макромолекул из раствора на поверхность, происходящий в критической точке, является фазовым переходом II рода, о чем свидетельствуют изломы в энергии и энтропии системы.
. При этом изменяется конформация цепей. В докритической области макромолекула представляет собой невозмущенный гауссов клубок. После адсорбции, при слабом покрытии поверхности, макромолекулы теряют свойства гауссовых клубков в направлении, перпендикулярном поверхности адсорбента и представляют собой последовательность адсорбированных участков и соединяющих их петель, средние размеры которых определяются величиной энергии сорбции. Переход макромолекул из раствора на поверхность, происходящий в критической точке, является фазовым переходом II рода, о чем свидетельствуют изломы в энергии и энтропии системы.
Рост термодинамической жесткости цепи (увеличение сегмента) приводит к убыванию критической энергии 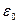 , требуемой для начала адсорбции. Это объясняется тем, что энтропийные потери цепи при адсорбции убывают с ростом жесткости, т.е. для их компенсации требуется меньшая энергия связывания с поверхностью.
, требуемой для начала адсорбции. Это объясняется тем, что энтропийные потери цепи при адсорбции убывают с ростом жесткости, т.е. для их компенсации требуется меньшая энергия связывания с поверхностью.
Вторичная структура макромолекулы влияет на ее адсорбцию, т. к. сорбционная активность спиральных и клубковых звеньев различна. И наоборот, степень спиральности адсорбированных цепей отличается от исходной степени спиральности макромолекул в растворе.
При рассмотрении адсорбции полимеров из разбавленного раствора необходимо принимать во внимание конформацию макромолекулы, характеризуемую средними размерами цепи 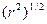 и
и 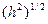 .
.
Изотермы адсорбции полимеров из раствора отличаются от изотерм Ленгмюра. Иногда изотермы представляют собой кривые с одним или двумя максимумами. Один максимум имеет изотерма адсорбции полиметилметакрилата из толуольного раствора.
При адсорбции макромолекул на твердой поверхности различают четыре типа центров поверхности: занятые 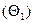 , экранированные макромолекулой
, экранированные макромолекулой 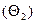 , находящиеся между адсорбированными макромолекулами в количестве, меньшем минимально необходимого для удержания макромолекулы на поверхности
, находящиеся между адсорбированными макромолекулами в количестве, меньшем минимально необходимого для удержания макромолекулы на поверхности 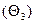 , свободные
, свободные 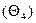 (рис. 5.7). Сумма относительных количеств центров каждого типа, равна единице, т.е.
(рис. 5.7). Сумма относительных количеств центров каждого типа, равна единице, т.е. 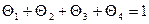 .
.
Многоцентровый характер адсорбции полимеров из раствора приводит к образованию в пределах одной макромолекулы участков непосредственно контактирующих с поверхностью, (эшелонов), свободных "хвостов" и "петель". Современные теории адсорбции позволяют дать количественную характеристику адсорбированной макромолекулы. Можно вычислить средние длины хвостов, участков, контактирующих с поверхностью, петель и их распределение по размерам. С учетом энтропии образование "хвостов" предпочтительнее образования "петель". Петли обладают меньшей конформационной свободой, чем хвосты такой же длины, что затрудняет приближение "петель" к поверхности. Можно получить также концентрационные профили сегментов петель и хвостов.
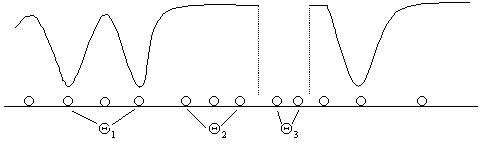
Рис. 5.7. Адсорбция макромолекул на твердой поверхности.
При построении теоретической ленгмюровской изотермы адсорбции учитываются только два типа центров: свободные и занятые.
При построении экспериментальной изотермы адсорбции учитываются все четыре типа центров. Это приводит к значительному отличию теоретической и экспериментальной изотерм (рис. 5.8).
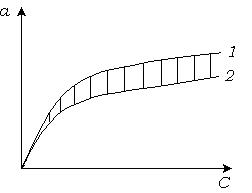
Рис. 5.8. Расчетная (1) и экспериментальная (2) изотермы адсорбции.
При малой концентрации макромолекул в растворе расчетная и экспериментальная изотермы совпадают, т.к. число свободных центров много больше числа занятых центров, 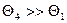 , а
, а 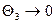 .
.
VI. Коллоидные ПАВ
Введение
К коллоидным ПАВ относятся вещества, состоящие из асимметричных молекул с одной или несколькими гидрофильными группами и гидрофобным радикалом. В отличие от низкомолекулярных спиртов и жирных спиртов, которые истинно растворимы при низкой концентрации, а при высокой образуют макро фазу, коллоидные ПАВ способны к обратимым переходам от истинного раствора к золю и гелю при изменении концентрации, температуры, рН, добавлении электролита. Помимо способности снижать поверхностное натяжение в разбавленных растворах, коллоидные ПАВ обладают двумя существенными способностями :способностью к образованию мицелл и к солюбилизации нерастворимых в воде веществ, т.е. к включению в ядро мицеллы нерастворимых частиц
Дата добавления: 2020-11-18; просмотров: 867;











