Гомогенное распределение микрокомпонента между твердой и жидкой фазами
Процессы изоморфной и изодиморфной сокристаллизации в зависимости от условий опыта могут приводить к гомогенному или гетерогенному распределению радиоактивного элемента между твердой и жидкой фазами. При этом гомогенным мы будем называть такое распределение, которое характеризуется установлением термодинамического равновесия между кристаллом в целом и раствором.
Вопрос о распределении веществ, в частности электролитов,
между твердой фазой и раствором привлекал внимание химиков уже в 90-х годах прошлого столетия, когда были осуществлены классические исследования Я. Вант-Гоффа и Б. Розебума. Теоретические работы этих ученых были посвящены
изучению твердых растворов и условий равновесия между смешанными кристаллами и растворами, из которых произошло ихвыделение. Применимость газовых законов к разбавленным растворам, не исключая и кристаллических растворов или изоморфных смесей, открывала перед исследователями возможность определять экспериментальным путем молекулярное состояние в твердых телах.
Распределение вещества между кристаллической и жидкой фазами должно происходить по закону, аналогичному тому, который управляет распределением вещества между газообразной и жидкой фазами (закон Генри — Дальтона) и между двумя жидкими фазами (закон Бертло — Нернста), т. е. должно быть справедливым соотношение:
KN = 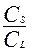 (1)
(1)
где с(S) и с(L)—равновесные концентрации микрокомпонента в твердой и жидкой фазах; КN — константа распределения (константа Нернста),
Очевидно, что закон распределения вещества между двумя фазами может быть справедливым в простой форме (1) при следующих условиях:
а) если имеет место истинное термодинамическое равновесие между кристаллами и раствором;
б) если процесс распределения происходит при неизменном составе фаз и постоянных внешних условиях (температура и давление); ,
в) если молекулярное состояние распределяющегося вещества в обеих фазах одинаково.
Однако, возможность распределения радиоактивных элементов в системах типа «раствор — твердая кристаллическая фаза» по закону Бертло — Нернста оспаривалась рядом видных ученых, в том числе Г. Тамманом и О. Ханом. Основным теоретическим доводом этих ученых являлось то, что в силу чрезвычайной медленности диффузионных процессов в твердом теле при низких температурах они не могут обеспечить состояния истинного термодинамического равновесия между кристаллами и раствором.
Но исследования В. Г. Хлопина и его учеников показали, что в определенных условиях в таких системах может устанавливаться истинное термодинамическое равновесие, и, следовательно, должен иметь место закон распределения Бертло — Нернста. Отправным моментом для этих исследований послужили наблюдения за разделением радия и бария в процессе дробной кристаллизации их хлоридов. Наблюдения эти говорили о том, что исследователи имели дело с системами, весьма близкими к состоянию истинного равновесия между кристаллами и раствором. Поэтому распределение радия при процессах дробной кристаллизации можно было рассматривать как распределение вещества между двумя несмешивающимися растворителями (в данном случае между кристаллической фазой и раствором). Следовало ожидать далее, что распределение это будет подчиняться закону Бертло — Нернста, что и оправдалось в действительности.
Одной из важнейших причин успеха исследований В. Г. Хлопина и его учеников явилось применение в качестве распределяющихся веществ радиоактивных элементов, т. е. изучение систем, крайне разбавленных в отношении одного из компонентов, что обеспечивало выполнение второго условия, необходимого для достижения распределения компонентов по закону Бертло — Нернста.
В своих первых работах по изучению соосаждения солей бария и радия В. Г. Хлопин и его ученики использовали для вычисления константы KN соотношение :
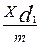 :
: 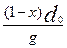 = KN (2)
= KN (2)
где g — масса жидкой фазы;
т — масса твердой кристаллической фазы;
d 0 и d1 — плотности твердой и жидкой фаз;
х — доля микрокомпонента, перешедшая в твердую фазу;
1-х — доля микрокомпонента, оставшаяся в жидкой фазе
В дальнейшем для представления экспериментальных данных по распределению компонентов между сосуществующими фазами более удобной оказалась формула, предложенная Л. Гендерсоном и Ф. Крэчеком:
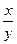 :
: 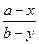 =D (3)
=D (3)
где х и у - количества макро- и микрокомпонентов, перешедших в кристаллическую фазу; а и b — первоначальные количества макро- и микрокомпонентов в системе; D — коэффициент кристаллизации.
Величина D отражает сущность процесса распределения микрокомпонента между кристаллической фазой и раствором: она показывает, во сколько раз отношение между количествами микро- и макрокомпонентов в кристаллах больше (D > 1), равно (D = 1) или меньше (D < 1), чем аналогичное отношение в растворе, равновесном с кристаллами.
Было показано, что связь между константами распределения (KN) и кристаллизации (D) дается выражением:
D = KN∙ 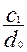 (4)
(4)
Где с1- концентрация микрокомпонента в равновесном растворе; d0 – плотность кристаллической фазы.
Экспериментальное доказательство применимости закона Бертло — Нернста к распределению электролитов между растворами и кристаллами оказалось довольно трудным. Это объяснялось, в основном, тем, что благодаря практически полному отсутствию в кристаллах диффузии (при комнатной температуре) не удавалось осуществить первое из отмеченных выше условий — истинное равновесие между раствором и кристаллами. Однако и при низких температурах удалось в конце концов найти путь, ведущий к выравниванию концентраций в твердой фазе. Таким путем, как показал В. Г. Хлопин, может служить перекристаллизация.
Оказалось, что в случае образования кристаллов из сильно пересыщенных растворов число первоначально возникающих кристаллизационных центров во много раз превышает число выросших впоследствии кристаллов. Таким образом, росту кристаллов предшествует образование большого числа зародышей, которые еще в стадии субмикронов успевают многократно перекристаллизоваться и таким путем гомогенизироваться. Рост кристаллов в этом случае происходит путем срастания отдельных однородных кристаллов (субмикронов),
Для подтверждения возможности экспериментального осуществления истинного термодинамического равновесия между твердой кристаллической фазой и раствором В. Г. Хлопин использовал несколько путей.
Первый путь состоял в длительной многократной перекристаллизации кристаллов макрокомпонента в его насыщенном растворе, содержащем микрокомпонент. С этой целью в стеклянные пробирки отвешивали примерно равные количества мелкоизмельченной соли чистого макрокомпонента, а затем добавляли в них по 25 мл насыщенного раствора макрокомпонента, содержащего радиоактивный элемент. После этого пробирки помещали в термостат и энергично перемешивали смесь до тех пор, пока концентрация микрокомпонента в насыщенном растворе не переставала изменяться. После окончания опыта отбирали пробы раствора для определения содержания в них макро- и микрокомпонента. Как показали опыты, время установления равновесия зависит от свойств макрокомпонента и температуры (при 25° оно составляет примерно 3—4 недели).
Этот путь позволял проследить за ходом установления равновесия «снизу».
Второй путь состоял в кристаллизации из пересыщенного раствора при энергичном перемешивании. С этой целью приготовляли насыщенный при определенной температуре (обычно О и 25°) раствор макрокомпонента, содержащий микрокомпонент, и мелкоизмельченную чистую соль макрокомпонента. В стеклянные пробирки емкостью 75—100 мл, снабженные притертыми пробками, отвешивали различные количества соли макрокомпонента и добавляли по 25 мл насыщенного раствора. Количество добавленного раствора определяли взвешиванием. После этого пробирки закрывали и нагревали на водяной бане до полного растворения твердой фазы. По окончании растворения пробирки помещали в термостат, имеющий температуру, одинаковую с той, при которой приготовлялся насыщенный раствор макрокомпонента. После этого раствор энергично перемешивали в течение 4—8 часов до полного снятия пересыщения. Далее отделяли осадок и производили химический анализ твердой и жидкой фаз на содержание в них макро- и микрокомпонента
Третий путь состоял в длительной многократной перекристаллизации заранее приготовленных смешанных кристаллов макро- и микрокомпонента в насыщенном растворе макрокомпонента. С этой целью приготовляли насыщенный при определенной температуре раствор чистого макрокомпонента и мелкоизмельченные смешанные кристаллы макро- и микрокомпонента. Далее отвешивали приблизительно равные количества смешанных кристаллов, добавляли 25 мл насыщенного раствора и производили длительное перемешивание при определенной температуре до установления равновесия. После этого раствор и твердую фазу анализировали на содержание в них макро- и микрокомпонента.
Этот путь позволял проследить за ходом установления равновесия «сверху».
Таким образом, при условии достижения истинного термодинамического равновесия распределение изоморфного или изодиморфного микрокомпонента должно подчиняться соотношению (1), т. е. следовать закону, который применительно к системе типа жидкость — твердое тело называется законом Хлопина и может быть сформулирован в общей форме следующим образом: при достижении термодинамического равновесия между кристаллами и раствором двух веществ, способных образовывать истинные твердые растворы, распределение компонентов между фазами следует линейному закону, согласно которому отношение концентраций компонентов в сосуществующих фазах является величиной, не зависящей от соотношения объемов фаз.
При ничтожно малых концентрациях одного из компонентов КN не только не зависит от соотношения объемов фаз, но и сохраняет свое значение в весьма широком интервале концентраций (обычно до 10-2 М). При значительном увеличении концентраций КN, как правило, изменяется, поскольку изменяется состав фаз.
Если вместо концентраций использовать активности, то величина КN оказывается постоянной при любых концентрациях компонента.
Дата добавления: 2021-10-28; просмотров: 540;











