Адсорбция радионуклидов на полярных кристаллах.
Первые систематические исследования в области адсорбции радиоактивных элементов на поверхности кристаллических осадков были выполнены К. Фаянсом и Ф. Панетом, которые сформулировали эмпирические правила соосаждения и адсорбции ( см. лекцию по соосаждению).
По правилу соосаждения, сформулированному К. Фаянсом, чем меньше растворимость соединения, образуемого радиоактивным элементом с противоположно заряженным ионом осадка, тем большее количество этого элемента захватывается осадком.
Закономерности, управляющие захватом микроколичеств радиоактивных элементов при образовании в растворах различного рода твердых фаз, были применены Ф. Панетом для случая адсорбции на предварительно приготовленных осадках. Правило адсорбции, сформулированное Ф. Панетом, по сути дела не отличается от правила соосаждения Фаянса, вследствие чего их обычно объединяют под общим названием правила соосаждения и адсорбции Фаянса — Панета, Это объединенное правило можно сформулировать следующим образом: радиоактивный элемент, находящийся в форме катиона или аниона тем сильнее адсорбируется выделяющимся или заранее приготовленным осадком, чем меньше растворимо соединение, которое образует этот элемент с противоположно заряженной частью осадка.
Однако со временем были установлены такие факты, которые находились в явном противоречии с этим правилом. В частности, было установлено, что на величину адсорбции радиоактивных элементов сильное влияние оказывает, помимо растворимости, знак заряда поверхности осадка. Так, положительно заряженные золи галогенидов серебра не адсорбируют заметным образом положительно заряженных ионов свинца (ТЬВ). Наоборот, золи отрицательно заряженных галогенидов серебра адсорбируют ТЬВ, причем величина адсорбции растет с увеличением отрицательного заряда частиц адсорбента.
Отмеченные выше факты побудили О. Хана сформулировать правило адсорбции, учитывающее влияние не только малой растворимости, но и знака заряда поверхности осадка. Однако, как показали дальнейшие исследования правила Фаянса — Панета — Хана носят чисто качественный характер и не учитывают возможности проявления различных видов адсорбционных процессов, каждый из которых имеет свои особенности. В частности было установлено, что радионуклид может адсорбироваться и на одноименно заряженных поверхностях. В то же время иногда радионуклид не адсорбировался и на противоположно заряженных кристаллах.
Первое количественное описание адсорбционных явлений в радиохимии и их классификацию дал в своих работах А. П. Ратнер. Согласно классификации Ратнера, адсорбционные процессы на гетерополярных кристаллах по характеру адсорбированных ионов и природе адсорбционных сил могут быть сведены к двум группам: к первичной и вторичной адсорбции.
В случае первичной адсорбции адсорбированные ионы входят в состав кристаллической решетки адсорбента. Первичная адсорбция подразделяется на первичную потенциалобразующую и первичную обменную.
В случае вторичной адсорбции адсорбированные ионы не входят в состав кристаллической решетки, а остаются в прилегающем к кристаллу тонком слое раствора. Вторичная адсорбция также делится на два вида: обменную и ван-дер-ваальсовскую. Вторичная обменная адсорбция обусловлена ионным обменом и электростатическим взаимодействием во внешней обкладке двойного слоя. Ван-дер-ваальсовская вторичная адсорбция связана с обменом адсорбированных молекул воды с ионами обоего знака в эквивалентных количествах.
При адсорбции радиоактивных элементов потенциалобразующая и ван-дер-ваальсовская адсорбция практически не имеют значения, так как обычно радиоактивный элемент находится в микроконцентрациях и поэтому не может создать потенциалобразующий слой.
Следует отметить, что, кроме первичной и вторичной адсорбции ионов, существует малоизученная форма адсорбции по всему объему кристалла, называемая внутренней адсорбцией. Внутренняя адсорбция может происходить, когда соосаждаемые радиоактивные и макроэлементы не изоморфны, но обладают сходной кристаллической структурой. Такая адсорбция с количественной стороны характеризуется константой фракционирования, являющийся постоянной величиной при постоянной концентрации радиоактивного элемента и уменьшающейся с ростом последней.
Первое обстоятельство сближает внутреннюю адсорбцию с сокристаллизацией, а второе обстоятельство — различает их. Константа фракционирования в сильной степени зависит от присутствия многовалентных катионов. При внутреннеадсорбционных процессах термодинамическое равновесие устанавливается достаточно быстро. Впервые явление внутренней адсорбции было обнаружено Ханом при соосаждении микроколичества свинца (ТЬВ), радия (ТЬХ) и полония с хроматами и сульфатами щелочных металлов.
Исходя из конкретных представлений о причинах возникновения отдельных видов адсорбционных явлений, А. П. Ратнер вывел ряд полуколичественных соотношений, описывающих процессы адсорбции радиоактивных элементов.
В основе теории адсорбции на кристаллических осадках лежит понятие о двойном электрическом слое, возникающем на границе раздела «раствор электролита — ионный кристалл или металл». Он характеризуется разностью потенциалов, которая зависит от активности электролита и описывается уравнением Нернста.
Двойной электрический слой на ионных кристаллах образуется следующим образом. Поверхность такого кристалла состоит из положительных и отрицательных ионов, находящихся в равновесии с соответствующими ионами раствора. Благодаря статистическим флюктуациям на отдельных участках поверхности кристаллов появляется избыточный заряд, который компенсируется зарядом ионов раствора, образующих на поверхности адсорбента внутреннюю обкладку двойного слоя. Внешняя обкладка двойного электрического слоя составлена из ионов раствора, имеющих заряд, противоположный заряду поверхности.
Первым экспериментальным доказательством того, что адсорбция связана с образованием двойного электрического слоя, была работа по изучению
адсорбции 212 РЬ (ТhВ) на осадках йодистого серебра в присутствии избытка нитрата серебра или йодида калия в растворе. Было установлено, что при избытке KJ в растворе внутренняя обкладка двойного слоя состоит из ионов J- так как она всегда образуется одним из ионов, входящих в состав осадка. Поверхность кристалла AgJ имеет отрицательный заряд. Во внешнем диффузионном слое находятся ионы К+, называемые компенсирующими ионами. Картина меняется на обратную, если в растворе имеется избыток азотнокислого серебра. В этом случае поверхность кристалла AgJ заряжается положительно за счет адсорбции ионов Аg+, а компенсирующими ионами являются анионы NО3 -.
5.3. Первичная обменная адсорбция
Если ионный кристалл помещается в раствор, содержащий собственные, изотопные или изоморфные ионы, то между поверхностью кристалла и раствором весьма быстро устанавливается динамическое равновесие; при этом скорости перехода ионов с поверхности кристалла в раствор и из раствора в кристалл оказываются равными.
Перенос собственных изотопных или изоморфных ионов из раствора на поверхность ионного кристалла в результате кинетического обмена получил название первичной обменной адсорбции.
При первичной обменной адсорбции ионы радионуклида входят в поверхностный слой
кристалла адсорбента. По механизму первичной адсорбции из раствора могут
адсорбироваться те ионы, которые способны входить в кристаллическую решетку адсорбента. Заметим, что для осуществления первичной
адсорбции достаточно поверхностного изоморфизма между соответствующими соединениями. Так, хотя СаSO4 и ВаSO4 не способны совместно кристаллизоваться, первичная адсорбция ионов кальция на осадке ВаSO4 имеет место, так как в данном случае существует двумерное подобие между гранями кристаллических решеток обоих сульфатов.
При первичной адсорбции распределение адсорбируемого иона между раствором и поверхностью твердой фазы определяется соотношением:
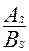 = D
= D 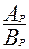 (1)
(1)
где AS и АP - количество радионуклида на поверхности твердой фазы и в объеме раствора соответственно; ВS и ВP - количество макрокомпонента в этих фазах; D — коэффициент сокристаллизации, величина которого зависит от температуры и природы участвующих в адсорбции ионов.
При адсорбции изотопных ионов D=1. Первичная обменная адсорбция была впервые изучена Ф. Пакетом на примере адсорбции ТhВ на поверхности кристаллов PbSO4. В этом случае соотношения между числами атомов радиоактивного и стабильного свинца на поверхности и в растворе должны быть одинаковы. Совершенно очевидно, что в случае первичной адсорбции ТhВ на кристаллическом осадке РbSО4 кинетический обмен между ионами поверхности осадка и ионами раствора должен приводить к выравниванию изотопного состава свинца на поверхности и в растворе.
Следует отметить, что АS , Ар и Вр можно определить экспериментально, тогда имеется возможность рассчитать ВS, а отсюда физическую поверхность осадка. С этой целью уравнение первичной обменной адсорбции приводится к виду:
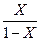 = D
= D 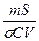 (2)
(2)
где 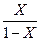 - коэффициент адсорбции, Х- доля адсорбированного радионуклида; С-концентрация макрокомпонента, моль/л; m- масса осадка; S- уд. Поверхность осадка; σ – поверхность, занимаемая одним молем ионов макрокомпонента; V- объем раствора..
- коэффициент адсорбции, Х- доля адсорбированного радионуклида; С-концентрация макрокомпонента, моль/л; m- масса осадка; S- уд. Поверхность осадка; σ – поверхность, занимаемая одним молем ионов макрокомпонента; V- объем раствора..
Следует отметить, что приведенные уравнения первичной обменной адсорбции строго выполняются лишь при соблюдении следующих условий:
1) в обмене участвуют только ионы поверхностного слоя кристаллического осадка;
2) в обмене участвуют все ионы, находящиеся на поверхности кристаллического осадка.
Используя последнее уравнение, рассмотрим влияние различных факторов на процесс первичной обменной адсорбции.
Дата добавления: 2021-10-28; просмотров: 786;











