Порядок и энергия связи
В методе МО вместо кратности связи вводится понятие порядок связи ω, который равен половине разности числа электронов на связывающих Nсв и разрыхляющих Nразр MO.
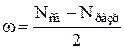 . .
| (4.3) |
Если число Nсв = Nразр, то ω = 0 и молекула не образуется.
В отличие от метода ВС в методе МО допускается, что химическая связь может быть образована не только парой, но и одним электроном и соответственно порядок связи может быть не только целым, но и дробным числом: ω = 1/2; 1; 3/2; 2; 5/2; 3.
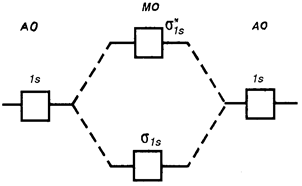
Рис. 4.11. Диаграмма энергетических уровней АО атомов и МО двухатомных молекул первого периода.
Энергия связывающих МО ниже энергии разрыхляющих МО (рис. 4.12). Энергия связи возрастает при переходе от комбинаций АО первой оболочки к комбинациям АО второй и других оболочек с более высокими главными квантовыми числами. Энергия МО, образуемых из s-АО, (σS) ниже энергии МО, образуемых из p-АО или d-AO (рис. 4.13).
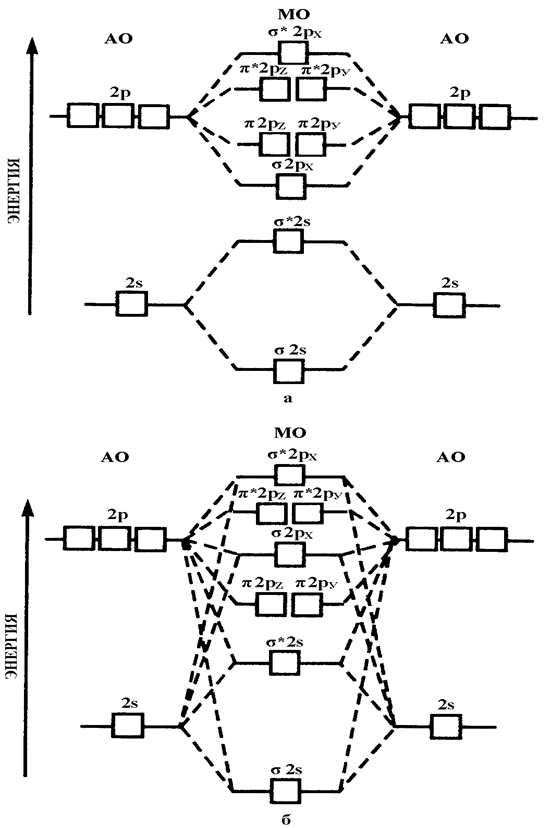 Рис. 4.12.Диаграмма энергетических уровней АО и МО двугомоядерных молекул элементов от начала (до N2) (а) и до конца (от N2 до F2) (б) второго периода.
Рис. 4.12.Диаграмма энергетических уровней АО и МО двугомоядерных молекул элементов от начала (до N2) (а) и до конца (от N2 до F2) (б) второго периода.
Однако соотношение уровней энергий σX- и π- МО может измениться даже в одном и том же периоде из-за взаимодействия электронов МО, у которых разница энергий не очень велика (рис. 4.13). Например, по возрастанию энергии МО орбитали двухатомных молекул первого периода и начала второго периода (до N2) можно расположить в следующий ряд (разрыхляющие орбитали обозначаются звездочкой):
σ 1s < σ* 1s <σ 2s < σ* 2s < π 2рУ = π 2рZ < σ 2pX < π* 2рУ = π* 2pZ < σ* 2pX.
Молекулярные орбитали двухатомных молекул конца второго периода по возрастанию энергии располагаются в несколько иной ряд:
σ 1s < σ* 1s <σ 2s < σ* 2s < σ 2рX < π 2рУ = π 2рZ < π* 2pУ = π* 2pZ < σ* 2рX.
Дата добавления: 2017-11-21; просмотров: 1498;











