Электронные конфигурации молекул
Образование химической связи можно записать через электронные конфигурации атомов и молекул. Электронные конфигурации молекул записываются через обозначения МО. Например, образование химической связи в двухатомной молекуле лития может быть представлено через электронные конфигурации атомов и молекулы лития:
2 Li [1s2 2s1] ® Li2 [(σ 1s ) 2 (σ* 1s) 2 (σ 2s) 2].
Так как энергии σ 1s и σ* 1s взаимно компенсируют друг друга, то они не участвуют в образовании химической связи и называются внутренними несвязывающими МО, поэтому в сокращенной записи могут либо не записываться, либо иметь условное обозначение, например К. Соответственно сокращенная электронная конфигурация молекулы Li2 имеет формулу Li2 [К1 (σ 2s) 2 ] , молекулы Na2 – Na2 [К2 (σ 3s) 2 ] , молекулы Br2 – Br2 [К1 (σ 2s ) 2 (σ* 2s) 2 (π 2pУ) 2], молекулы N2 – N 2 [К1 (σ 2s ) 2 (σ* 2s) 2 (π 2pУ) 2 (π 2pZ) 2 (σ 2pX) 2 ] .
Образование химической связи в молекуле водорода можно представить электронными конфигурациями:
2 Н [1s1] ® Н2 [(σ 1s ) 2].
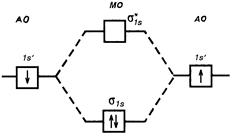
В соответствии с энергетической диаграммой (рис. 4.14) при образовании связи два 1s- электрона окажутся на σ 1s-молекулярной орбитали, а σ* 1s-орбиталь будет незаполненной. Соответствующий порядок связи равен 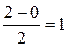 . Молекулярный водород диамагнитен.
. Молекулярный водород диамагнитен.
|
Рис. 4.13. Энергетическая диаграмма АО атомов водорода и МО молекул водорода.
При взаимодействии атома и положительно заряженного иона водорода образуется молекулярный ион Н2+: Н [1s1] + Н+ [1s0] ® Н2+ [(σ 1s)1]. Порядок связи МО равен 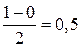 , длина связи у молекулы Н2 меньше, а энергия связи больше, чем у молекулярного иона Н2+ .
, длина связи у молекулы Н2 меньше, а энергия связи больше, чем у молекулярного иона Н2+ .
Метод МО указывает на возможность образования отрицательно заряженного молекулярного иона Н2–: Н [1s1] + Н– [1s 2] ® Н2– [(σ 1s ) 2 (σ* 1s ) 1].
Методы ВС и МО не исключают, а взаимно дополняют друг друга. Метод ВС позволяет объяснить химические связи и свойства многих соединений. Метод МО обеспечивает общий подход ко всем типам химических соединений.
Дата добавления: 2017-11-21; просмотров: 2222;











