Элементы 3-а группы
Строение электронной оболочки: …ns2np1.
5B, 13Al, 31Ga, 49Jn, 81Tl.
В – неметалл (с.о. = +3, -3).
Al, Ga, Jn – амфотерны (с.о. = +3).
Tl – металл (с.о. = +3, +1); похож по свойствам на щелочные металлы и серебро.
БОР и его соединения
Физические свойства: аллотропен, полупроводник, t°пл. b-модификации = 2074°С; t°кип. (b) = 3658°С.
Химические свойства
1. Инертен, без нагревания идёт только реакция 2В + 3F2 = 2BF3.
2. При нагревании (400 – 1200°С) может быть
а) восстановитель: 2В + 3О2 = 2В2О3;
2В + 3Cl2 = 2ВCl3;
2В + N2 = 2ВN (борозан);
б) окислитель: 2В + 3Са = Са3В2 (борид).
3. Реакции со сложными веществами тоже малохарактерны и протекают при особых условиях:
а) 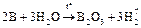 ;
;
б) В + 3HNO3 конц. = Н3ВO3 + 3NO2; (или с H2SO4 конц. , «царской водкой»)
.
Из сложных соединений бора можно выделить следующие группы соединений:
1) Бориды – соединения переменного состава (например, Cr4B, Cr2B, CrB, Cr3B4); твёрдые, химически прочные, жаростойкие.
2) Бораны – соединения с водородом состава BnHn+4; BnHn+6. Ядовиты, с неприятным запахом, могут быть в различном агрегатном состоянии. Простейший из этого семейства: диборан В2Н6, неустойчив;
а) В2Н6 + 3О2 = В2О3 + 3Н2О;
б) В2Н6 + 6 Н2О = 2Н3ВО3 + 6H2.
3) Гидридобораты – устойчивые твёрдые вещества с различным типом связей:
а) с ионным типом связей, например Na[BH4];
б) с ковалентным типом связей - Al[BH4]3.
4) Галогениды – все они кислоты по Льюису, существуют в различном агрегатном состоянии, отличаются хорошей реакционной способностью:
а) BCl3 + 3Н2О = H3BO3 + 3HCl;
б) 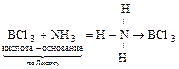 ;
;
в) образуют комплексы, как правило анионные:
NaF + BF3 = Na[BF4];
NaOH + BF3 = Na[BF3OH].
5) Борный ангидрид, его кислоты и соли
В2О3 – бесцветная, стекловидная, устойчивая масса. Ему соответствуют следующие кислоты и соли:
Н3ВО3 – ортоборная кислота; солей нет;
(Н2В4О7) – тетраборная кислота; существует в виде растворимых солей, щелочных металлов (Na2В4О7 × 10H2O - бура);
(НВО2) – метаборная кислота; существует в виде малорастворимых солей (AgBO2 и др.).
Н3ВО3 – кислота слабая, единичных молекул нет, существует в виде полимеров. Кислотные свойства обусловлены способностью к комплексообразованию; при растворении в воде образуется комплексный ион и высвобождается часть ионов Н+:
Н3ВО3 + НОН = [В(ОН)4]- + Н+.
Гидролиз солей бора идёт в одну ступень:
Na2B4O7 + 7H2O = 4H3BO3 + 2NaOH
( 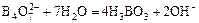 ).
).
6) Бороорганические соединения – большой класс соединений, например:
а) бороуглероды ( С2В10Н12 и др.);
б) эфиры одноатомных спиртов (B-(O-R)3) (их горение является реакцией открытия борат-ионов в растворах: горят зелёным пламенем).
АЛЮМИНИЙ и его соединения
Физические свойства: серебристо-белый, лёгкий, прочный, электро- и теплопроводный металл; t°пл. = 660°С; t°кип. = 2452°С; плотность = 2,7 г/см3. На воздухе покрывается тонкой оксидной плёнкой Al2O3, очень прочной.
Химические свойства
Активен, степень окисления = +3.
1. Реакции с простыми веществами:
4Al + 3O2 = 2Al2O3;
2Al + 3Cl2 = 2AlCl3;
4Al + 3C = Al4C3.
2. Реакции со сложными веществами:
2Al + 6H2O = 2Al(OH)3 + 3H2;
2Al + 6HCl = 2AlCl3 + 3H2;
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2;
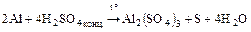 .
.
3. Оксид и гидроксид алюминия амфотерны:
Al2O3 + 6HCl = 2AlCl3 + 3H2O;
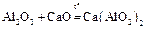 ;
;
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O;
Al(OH)3 + KOH + 2H2O = K[Al(OH)4(H2O)2].
(или K[Al(OH)4], K3[Al(OH)6])
4. Алюмотермия: восстановление металлов из их оксидов с помощью алюминия; так получают многие металлы, в том числе Cr, Mn, Ti, V, …
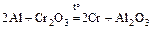 .
.
Дата добавления: 2017-10-04; просмотров: 1425;











