Элементы 4-а группы
Строение электронной оболочки: …ns2np2.
УГЛЕРОД и его соединения
Встречается в почве (карбонаты), в воздухе (углекислый газ), основа живой и растительной жизни.
Физические свойства
Аллотропен: а)алмаз (sp3 – гибридизация, тетраэдр) – самый твердый, не проводит электрический ток;
б)графит (sp2 – гибридизация, гексагональное строение) – легко расслаивается, проводит электрический ток;
в)карбин (sp – гибридизация, линейное строение) – полупроводник;
г)угли (рентгеноаморфны) – кокс, древесный и костяной уголь, сажа.
Химические свойства углерода и его соединений.
1)Реакции с простыми веществами:
С + О2 = СО (СО2)
С + Н2 = СН4
С + 2CI2 = СCI4
2)Реакции со сложными веществами (при повышенной при to):
а) С + Н2О = СО + H2 ,
б) С + СО2 = 2СО,
в) С + FeO = Fe + CO,
г) С + H2SO4(конц.) ® H2СO3 (или СO2 ) + SO2
С + HNO3(конц.) ® H2СO3 (или СO2 ) + NO (или NO2 )
Степень окисления +2
СО – закись углерода, «угарный газ» - бесцветный ядовитый газ, без запаха.
Получение оксида углерода (П):
а) СО2 + С = 2СО (неполное выгорание каменного угля),
б)разложение муравьиной кислоты в присутствие H2SO4(конц.):
НСООН ® СО + H2О
Химические свойства оксида углерода (П):
1)Сильный восстановитель:
а)восстанавливает металлы из оксидов: Fe3O4 + 4CO = 3Fe + 4СO2 ,
б)СО + СI2 = СOCI2 – фосген (ядовит),
в)2СО + СО2 = 2СО2 .
2)Участвует в органическом синтезе, например СО + 2Н2 ® СН3ОН.
3)Ядовит, т.к. при неполном сгорании угля может быть «угар»: соединяется с гемоглобином крови, составляя конкуренцию кислороду, и в виде карбоксигемоглобина по артериальному руслу движется ко всем клеткам организма.
Степень окисления +4
1)СО2 – угольный ангидрид, «углекислый газ» - бесцветный тяжелый газ, не поддерживает горения. Твердый оксид (toпл. = -56,5оС) называют часто «сухой лед», т.к. при его таяние нет следов влаги.
Получение углекислого газа:
а)в лаборатории: СаСО3 + 2НСI = СаСI2 + Н2СО3 (СО2 + H2О),
б)в промышленности термическим разложением известняка:
СаСО3 ® СаО + СО2
2)Н2СО3 – слабая, неустойчивая угольная кислота:
К1 = 4,5 . 10-7 ;К2 = 4,7 . 10-11
3)Соли угольной кислоты (карбонаты и гидрокарбонаты):
а)кислые соли растворимы лучше средних,
б)соли хорошо гидролизуются: СО32- + НОН « НСО3-+ ОН- ,
в)при прокаливании соли разлагаются:
MgСО3 ® MgО + СО2 ,
2NaНСО3 ® Na2СО3 + СО2 + H2О,
4)CS2 – сероуглерод, летучая ядовитая бесцветная жидкость, растворитель:
CS2 + 3О2 = СО2 + 2SО2
CS2 + 2 H2О = СО2 + 2 H2S
5) Н2CS3 – тиоугольная кислота (слабая), маслянистая жидкость, разлагается водой: Н2CS3 + H2О = Н2CО3 + H2S
6) Cульфидокарбонаты (тиокарбонаты) – похожи на карбонаты;
а)их можно получить: К2S + CS2 = К2CS3
б)подобно карбонатам, тиокарбонаты разлагаются кислотами:
К2CS3 + 2НСI = Н2CS3 + 2КСI
Азотсодержащие соединения углерода.
1) (CN)2 –дициан NºC-CºN – ядовитый газ, получают при термическом разложении цианидов: Hg(CN)2 ® Hg + (CN)2
Похож на галоген: а) Н2 + (CN)2 = 2HCN (синильная кислота) – яд;
б)диспропорционирует (CN)2 + 2NaOH = 2NaCN + 2NaCNO.
2)HCN –синильная кислота и ее соли цианиды (ядовиты, смертельная доза 0,05г); кислота слабая, дает средние и комплексные соли:
а) 3KCN(яд) + Fe(CN)3 ® K3[Fe(CN)6](не ядовита),
б) 2KCN + О2 = 2KCNO (цианат K-O-CºN),
в) NaCN + S = NaCNS (тиоцианат Na-S-CºN).
3)Тиоцианаты (роданиды) – соли сильной тиоциановой (родановой) кислоты НCNS; хорошо растворимы, легко образуют комплексы:
3KCNS + Fe(CNS)3 ® K3[Fe(CNS)6].
4)CO(NH2) - мочевина (карбамид).
ОБЩАЯ ХАРАКТЕРИСТИКА ПОДГРУППЫ
6С, 14Si, 32Ge, 50Sn, 82Pb. Для них характерна аллотропия и поэтому нельзя однозначно говорить о физических свойствах какого-либо элемента. По подгруппе сверху вниз закономерно возрастают металлические свойства и это согласуется со значениями степеней окисления, проявляемыми элементами в соединениях:
| C | Si | Ge | Sn | Pb |
| неметалл | неметалл | амфотерный металл | Амфотерный металл | металл |
| -4, +2, +4 | -4, +2, +4 | +2, +4 | +2, +4 | +2, +4 |
Химические свойства
1. С простыми веществами дают бинарные соединения, которые по-разному взаимодействуют с водой:
С + О2 = СО2; СО2 + H2O Û Н2СО3;
Si + 2F2 = SiF4; 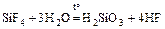 ;
;
Ge + 2Cl2 = GeCl4; 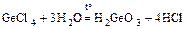 .
.
(GeO2 × H2O)
2. С кислотами взаимодействуют по-разному, в зависимости от преобладания неметаллической или металлической природы:
а) С + 2Н2SO4 конц. = CO2 + 2SO2 + 2H2O;
б) Sn + 4HNO3 конц. = H2SnO3 + 4NO2 + H2O;
в) Pb + 2HCl = PbCl2 + H2.
3. Реакции со щелочами также идут по-разному:
а) 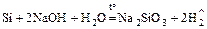 ;
;
б) 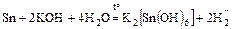 (
( 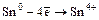 );
);
в) 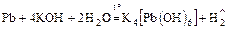 (
( 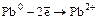 ).
).
4. Соли этих элементов гидролизуются, причём характер гидролиза закономерно меняется по подгруппе соответствующих элементов:
а) SnCl4 + 3H2O = H2SnO3¯ + 4HCl;
(SnO2 × H2O)
б) SnCl2 + H2O Û SnOHCl + HCl;
в) Pb(NO3)2 + H2O Û PbOHNO3 + HNO3.
5. У оксидов и гидроксидов этих элементов в зависимости от степени окисления соответственно меняются кислотные и основные свойства:
а) С+4 и Si+4 образуют слабые неустойчивые кислоты;
б) Для соединений элементов подгруппы германия со с.о. (+2) по ряду 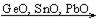 можно установить следующую закономерность: они амфотерны, основные свойства растут с увеличением порядкового номера. То же самое можно сказать и о гидроксидах.
можно установить следующую закономерность: они амфотерны, основные свойства растут с увеличением порядкового номера. То же самое можно сказать и о гидроксидах.
в) У соединений элементов подгруппы германия со степенью окисления (+4) по ряду: 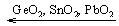 сохраняется амфотерность, причем кислотные свойства растут с уменьшением порядкового номера элемента. Образуют соли: мета – (германаты, станнаты, плюмбаты) Ме2ЭО3 и орто - Ме4ЭО4.
сохраняется амфотерность, причем кислотные свойства растут с уменьшением порядкового номера элемента. Образуют соли: мета – (германаты, станнаты, плюмбаты) Ме2ЭО3 и орто - Ме4ЭО4.
6. Элементы образуют комплексные соединения, проявляя значения к.ч. = 4 (для Э+2) и к.ч. = 6 (для Э+4):
SiF4 + 2NaF ® Na2[SiF6];
Sn(OH)4 + 2NaOH ® Na2[Sn(OH)6];
PbJ2 + 2KJ ® K2[PbJ4].
7. В окислительно-восстановительных реакциях элементы и их соединения проявляют двойственность:
а) Э0 – прежде всего восстановитель:
С + 2Cl2 = CCl4;
Sn + O2 = SnO2.
б) Э+2 – восстановители :
CO + Cl2 = COCl2;
SnCl2 + 2FeCl3 = SnCl4 + 2FeCl2,
в-ль
но могут быть и окислителями:
PbCI2 + Mg = Pb + MgCI 2
в) Э+4 – окислители (особенно активно Pb+4 ® Pb+2):
PbO2 + H2O2 = Pb(OH)2 + O2.
Дата добавления: 2017-10-04; просмотров: 1617;











