Элементы 5-а группы
Строение электронной оболочки: …ns2np3.
АЗОТ и его соединения
В природе встречается в свободном виде (содержание в воздухе – 78 объемных %), в виде минералов (селитры), в нефти, в растительных и животных белках.
Физические свойства
При обычных условиях N2 – газ без цвета, запаха и вкуса,
toкип.= -195,8оС.
Получение азота:
а) в промышленности – сжижением воздуха,
б) в лаборатории: NH4NO2 ® N2 + Н2О.
Химические свойства азота и его соединений.
Химическая активность молекулярного азота очень мала, т.к. благодаря тройной ковалентной связи молекула очень прочная (Есвязи = 946 кДж/моль). Однако известно много различных соединений для азота, в которых он проявляет степени окисления -3, -2, -1, +1, +2, +3, +4, +5.
Соединения азота с отрицательными степенями окисления.
Минимальная степень окисления -3
1)NH3 – аммиак – бесцветный газ с резким запахом, легко сжижается.
Получение аммиака:
а) N2 + 3H2 « 2NH3 (Kat: Fe, Al2O3, K2O)
б) 2NH4CI + Ca(OH)2 = CaCI2 + 2NH3 + 2H2O
Химические свойства аммиака:
а) NH3 + H2O « NH4OH (максимальная концентрация = 25%)
б) NH3 + HCI « NH4CI (дон.-акц. механизм: NH3 + Н+ = NH4+)
в)горение в зависимости от количества кислорода идет по-разному:
4NH3 + 3О2(нед.) = 2N2 + 6H2O
4NH3 + 5О2(изб.) = 2NО+ 6H2O
г) в ОВР аммиак всегда восстановитель:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
2) NH4OH – гидроксид аммония - слабое основание, неустойчивое, хорошо образует комплексные соединения (аммиакаты):
Cu(OH)2 + 4NH4OH = [Cu(NH3)4](OH)2 + 4H2O
3) Соли аммония:
а) растворы вследствие гидролиза имеют слабокислую реакцию:
NH4CI + НОН « NH4ОН+ НCI (NH4+ + НОН « NH4ОН + Н+)
б) термическое разложение солей аммония идет по-разному в зависимости от природы аниона: если анион – окислитель, то реакция разложения идет необратимо:
NH4CI « NH3 + HCI
NH4NO3 = N2О+ 2H2O
4) Амиды образуются при замещении атомов Н в аммиаке на металл:
2К + 2NH3 = 2КNH2 + H2
5) Нитриды известны для металлов и неметаллов и в зависимости от природы по-разному разлагаются:
а)Li3N + 3H2O = 3LiOH + NH3
Ca3N2 + 6HCI = 3CaCI2 + 2NH3
б)CI3N + 6HCI = 3HCIO + NH3
Степень окисления –2
N2Н4 – гидразин (диамид) – бесцветная жидкость, хороший растворитель, менее устойчив, чем аммиак.
Получение гидразина:
2NH3 + NaCIO = N2Н4 + NaCI + H2O
Химические свойства гидразина:
а) Водные растворы – слабые основания:
N2Н4 + H2O « [N2Н5]+ +OH-
[N2Н5]+ + H2O « [N2Н6]2+ +OH-
б) Сгорает до азота: N2Н4 + O2 = N2 + 2H2O
в) Сильный восстановитель: N2Н4 + 2H2O2 = N2 + 4H2O
Степень окисления –1
NH2OH – гидроксиламин, белое кристаллическое вещество, занимает промежуточное положение между H2O2 и гидразином N2Н4.
Получение гидроксиламина:
HNO3 + 6Н = NН2ОН + 2H2O
Химические свойства гидроксиламина:
а) Водные растворы – слабые основания:
NН2ОН + H2O « [NН3ОН]+ +OH-
б) С кислотами дают соли гидроксиламмония (устойчивые):
NН2ОН + HCI = [NН3ОН]+ + CI-
в) Разлагается (реакция диспропорционирования):
3NН2ОН = NН3 + N2 + 3H2O
г) Как и H2O2 , в зависимости от среды проявляет окислительно - восстановительную двойственность:
ок-ль: 2NН2ОН + 4FeSO4 + 3H2SO4 = 2Fe2(SO4)3 + (NH4)2SO4 + 2H2O
восст-ль: 2NН2ОН + I2 + 2KOH = N2 + 2KI + 4H2O
Наиболее важныесоединения азота с положительными с. о.
Степень окисления +3
1) N2О3 - оксид азота (III) или «азотистый ангидрид» - неустойчивая сине-зеленая жидкость:
а) N2О3 ® NО2(бурый газ с резким запахом) + NО(бесцветный газ);
б) с водой образует неустойчивую кислоту: N2О3 + H2O « 2 HNO2
2) HNO2 – азотистая кислота (средней силы):
HNO2 « H+ + NO2- (К = 5,1 . 10-4).
3) Нитриты – соли азотистой кислоты, как и другие соединения N+3 в окислительно-восстановительных реакциях, проявляют двойственность:
ок-ль: КNO2 + NH3 = N2 + H2O
восст-ль: КNO2 + H2O2 = КNO3 + H2O
Максимальная степень окисления +5
1) N2О5 - оксид азота (V) или «азотный ангидрид» - бесцветное кристаллическое вещество; при растворении в воде дает кислоту.
2) HNO3 – азотная кислота, сильная: HNO3 ® H+ + NO3-.
3) Нитраты – соли азотной кислоты:
а) в лаборатории можно получать N2О по реакции термического разложения: NH4NO3 ® N2О + Н2О;
б) нитраты металлов в зависимости от положения металла в ряду активности разлагаются по-разному:
левее Mg: нитрат ® нитрит + O2
Mg – Cu: нитрат ® оксид металла + NO2 + O2
правее Cu: нитрат ® металл + NO2 + O2 .
4)все соединения N+5 сильные окислители; взаимодействие азотной кислоты с металлами:
а) ни один металл не выделяет из HNO3 водород;
б) при обычной to пассивируются металлы Al, Zn, Cr, Fe, Pb, Au, Pt;
в) при нагревании c большинством металлов взаимодействует, причем чем активнее металл и разбавленнее кислота, тем сильнее восст-ся N+5:
неакт. Ме: Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
актив. Ме: 4Cа + 10HNO3(конц.) = 4Cа(NO3)2 + N2О + 5H2O
5Cа + 12HNO3(разб.) = 5Cа(NO3)2 + N2 + 6H2O
4Cа + 9HNO3 (оч. разб.) = 4Cа(NO3)2 + NН3(или NH4NO3)+ 3H2O
ФОСФОР и его соединения
В природе встречается: а)в виде минералов (фосфориты и апатиты), б)в растительных и животных белках, в)в тканях мозга и костях.
Физические свойства
Аллотропен:
а) белый фосфор (Р4) – тетраэдрическое строение, ядовит, светится в темноте, растворим в сероуглероде; при хранении постепенно переходит в красный фосфор, поэтому его хранят под водой;
б) красный фосфор (Р2n – полимер) – существует несколько форм строения, не ядовит, нерастворим в сероуглероде, устойчив при хранении, менее реакционоспособен;
в) черный фосфор – пирамидальное строение, слоистый, похож на графит, полупроводник.
Получение фосфора:
Минерал «фосфорит» прокаливают с коксом и песком:
Са3(РО4) + 5С + 3 SiО2 = 3СаSiО3 +2Р +5СО
Химические свойства фосфора и его соединений.
Химическая активность фосфора различна в зависимости от его аллотропной модификации. Основные степени окисления: -3, +1, +3, +5.
1) Реакции фосфора с простыми веществами:
восстановительные свойства: a)Р + О2 ® Р2О3, Р2О5;
б)Р + СI2 ® РCI3, РCI5 ; в) 2Р + 3S ® Р2S3
окислительные свойства: а)2Р + 3Н2 ® 2РН3, б)2Р + 3Са ® Са3Р2
2) Реакции фосфора со сложными веществами:
а) реакция с водой не идет,
б) 2Р + 5H2SO4(конц.) ® 2H3РO4 + 5SO2 + 2H2O,
в) Р + HNO3(конц.) ® H3РO4 + NO (или NO2 ).
3) Минимальная степень окисления -3
а) РН3 – фосфин, ядовитый газ с чесночным запахом,
горит: 2РH3 + 4О2 = Р2О5 + 3H2O,
с некоторыми кислотами дает соли фосфония: РH3 + HI = РH4I
б) фосфиды металлов – ионоковалентные соединения
Mg3P2 + 6 H2O = Mg(ОН)2 + 2РН3,
Са3P2 + 6HСI = CaCI2 + 2РН3.
4) Степень окисления +1
H3РO2 или Н[РO2H2] – фосфорноватистая кислота, сильная; соли – гипофосфиты, хорошо растворимы, хорошие восстановители.
5) Степень окисления +3
а) Р2О3 – фосфористый ангидрид, имеет несколько модификаций (Р2О3)n, бесцветные ядовитые кристаллы;
б) H3РO3 или H2 [РO3Н] – фосфористая кислота, средней силы;
в) соли фосфиты, растворимы только у щелочных металлов (К2 [РO3Н]),
г) галогениды довольно активны:
РСI3 + CI2 = PCI5 ,
РСI3 + О2 = PОCI3 ,
РСI3 + НCI ® Н[PCI4].
6) Максимальная степень окисления +5
а) Р2О5 – фосфорный ангидрид, белый порошок, имеет модификацию (Р2О5)2, сильное водоотнимающее средство: Р2О5 + 2H2O = 2HРO3;
б) HРO3 - мета, H4Р2O7 –пиро, H3РO4 –ортофосфорная кислота, средней силы;
в) соли мета-, пиро-, орто-фосфаты;
г) галогениды довольно активны:
РСI5 + 4H2O = H3РO4 +5НСI ,
РF5 + HF = Н[PF6].
ОБЩАЯ ХАРАКТЕРИСТИКА ПОДГРУППЫ
7N, 15P, 33As, 51Sb, 83Bi. По подгруппе сверху вниз металлические свойства закономерно увеличиваются и это согласуется со значениями степеней окисления, проявляемыми элементами в соединениях, а также с некоторыми физическими свойствами. Хотя аллотропия P, As и Sb создают определённые трудности при сведении физических свойств в единую таблицу:
Таблица 11
Свойства элементов пятой группы, главной подгруппы
| Элемент ® | N | P | As | Sb | Bi |
| Свойство ¯ | |||||
| R атома, нм | 0,07 | 0,13 | 0,15 | 0,16 | 0,18 |
| J, эв | 14,5 | 10,5 | 9,8 | 8,6 | 7,3 |
| Молекула, модификации | N2 (газ) неметалл | P2, P4, P200 неметалл: 1.белый 2.красный; 3. чёрный. | As 1. жёлтый (неустойчив); 2. серый (металлич.) | Sb 1. жёлтая (неуст.); 2.металли- ческая | Bi металл |
| Плотность, г/см3 | 0,81 (жидкий) | 2,69 (чёрный) | 5,7 (серый) | 6,68 (серый) | 9,80 |
| T°кип. , С | -195,8 | ||||
| Степени окисления | -3, -2, -1, +1, +2, +3, +4, +5 | -3 +1, +3, +5 | -3, +3, +5 | -3, +3, +5 | +3, +5 |
Химические свойства
1. С простыми веществами дают самые разные соединения, проявляя различную окислительно-восстановительную природу:
а) восстановительные свойства
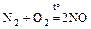 ;
;
2P + 3Cl2 = 2PCl3 (или PCl5);
4As + 5O2 = 2As2O5;
2Bi + 3Cl2 = 2BiCl3.
б) Окислительные свойства
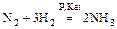 ;
;
2P + 3Ca = Ca3P2;
2As + 3Mg = Mg3As2.
2. С кислотами реагируют по-разному в зависимости от природы элемента подгруппы:
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O;
3As + 5HNO3 + 2H2O = 3H3AsO4 + 5NO;
3Sb + 5HNO3 = 3HSbO3 + 5NO + H2O;
2Sb + 6Н2SO4 конц. = Sb2(SO4)3 + 3SO2 + 6H2O;
Bi + 4HNO3 = Bi(NO3)3 + NO + 2H2O.
Необходимо помнить, что элементы подгруппы мышьяка в ряду активности стоят после водорода.
3. Гидролиз соединений идёт по-разному:
а) PCl3 + 3H2O = H3PO3 + 3HCl;
BiCl3 + H2O ® BiOCl¯ + 2HCl.
(SbCl3) (SbOCl)
б) NaNO2 + H2O Û HNO2 + NaOH;
K3PO4 + H2O Û K2HPO4 + KOH;
K3AsO4 + H2O Û K2HAsO4 + KOH.
4. Изменение кислотно-основных свойств у элементов проявляется по-разному
Таблица 12
Наиболее важные соединения элементов пятой подгруппы
| Азот | Фосфор | Мышьяк | Сурьма | Висмут |
| N+3, N+5 – кислотные HNO2– средняя HNO3 – сильная | P+1, P+3, P+5 – кислотные H3PO2 H3PO3 HPO3, H4P2O7, H3PO4 | As+3, As+5 – Кислотные H3AsO3 H[AsCl4] H3AsO4 | Sb+3 – амфотерные Sb(OH)3, SbCl5 NaSbO2 Sb+5 – кислотные KSbO3, K3SbO4 | Bi+3 – основные Bi(OH)3, BiCl3 Bi+5 – Кислотные KBiO3 |
5. Окислительно-восстановительная способность соединений зависит от степени окисления элемента:
а) Э-3 – восстановители
2NH3 + 6KМnO4 + 6KOH = 6K2MnO4 + N2 + 6H2O;
2PH3 + 4O2 = P2O5 + 3H2O.
б)
 окислители:
окислители:
2KNO2 + 4H2S = 3S + N2 + K2S + 4H2O
 Э+3 2BiCl3 + 3SnCl2 + 18KOH = 2Bi + 3K2SnO3 + 12KCl + 9H2O.
Э+3 2BiCl3 + 3SnCl2 + 18KOH = 2Bi + 3K2SnO3 + 12KCl + 9H2O.
восстановители:
10KNO2+4KМnO4+11H2SO4=10HNO3+4MnSO4+7K2SO4+6H2O
в) Э+5 – окислители
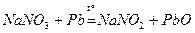 ;
;
Na3SbO4 + 2NaJ + H2SO4 = Na3SbO3 + J2 + Na2SO4 + H2O.
Элементы 6-а группы. (Халькогены)
Строение электронной оболочки: …ns2np4.
8O, 16S, 34Se, 52Te, 84Po(радиоактивен).
КИСЛОРОД и его соединения
Самый распространённый элемент на Земле: 21% (объемных) в воздухе, входит в состав Н2О, минералов, органических веществ.
Физические свойства
Существует в виде веществ:
а) «кислород» О2 – газ без цвета, вкуса, запаха, не ядовит, ; t°кип. = -183°С; 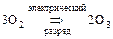 ;
;
б) «озон» О3 – голубой газ с резким запахом, ядовит, очень сильный окислитель; t°кип. = -111,8°С.
Химические свойства
1. Только в одной реакции кислород является восстановителем:
О2 + 2F2 = 2OF2 ( 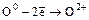 ).
).
2. Во всех остальных случаях кислород – окислитель, особенно если он находится в атомарном состоянии:
а) Окисление простых веществ
2Н2 + О2 = 2Н2О;
S + O2 = SO2;
2Ca + O2 = 2CaO.
б)Окисление сложных веществ
Р2О3 + О2 = Р2О5;
2SO2 + O2 = 2SO3;
2PCl3 + O2 = 2POCl3.
в) Горение сложных неорганических веществ
2H2S + O2 недост. = 2S + 2H2O;
2H2S + 3O2 изб. = 2SO2 + 2H2O.
г) Горение органических веществ
СН4 + 2О2 = СО2 + 2Н2О;
С2Н5ОН + 3О2 = 2СО2 + 3Н2О.
СЕРА и её соединения
В природе встречается в самородном виде; в виде минералов (сульфиды, сульфаты); в нефти; в белках.
Физические свойства
Твёрдая, хрупкая, жёлтого цвета, не растворима в Н2О, но растворима в сероуглероде, анилине. Аллотропна: ромбическая сера (a- форма); моноклинная (b - сера); пластическая и др. Наиболее устойчива модификация a (t°пл. » 113°С), ей приписывают состав S8.
Химические свойства
Cоединения, проявляя разные степени окисления, имеют разную окислительно-восстановительную способность.
Таблица 13
Наиболее важные соединения серы
| -2 | +2 | +4 | +6 | |
| а) Н2S, слабая сероводородная кислота; б) образует сульфиды: металлов (K2S), неметаллов (CS2) | а) взаимодействует с простыми веществами S + O2 = SO2 S + H2 = H2S б) со сложными | SCl2 соединения встречают-ся редко | SO2, H2SO3, Me2SO3, H2SO3 – сернистая к-та, средняя по силе, неустойчива | SO3, H2SO4, MeSO4 H2SO4 – сильная, устойчива |
| Восстановители | восстановитель, окислитель | восстановители и окислители | окислитель |
1. Сера, взаимодействуя со сложными соединениями, по-разному меняет свою степень окисления:
а) S + 2H2SO4конц. = 3SO2 + 2H2O ( 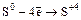 );
);
б) S + 6HNO3конц. = H2SO4 + 6NO2 + 2H2O ( 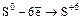 );
);
в) 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
реакция диспропорционирования 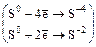
2. Соединения S-2
а) H2S – сероводород, ядовитый газ с запахом тухлых яиц, сильный восстановитель: 2H2S + O2 = 2S + 2H2O;
H2S + Cl2 = 2HCl + S.
б) Раствор Н2S – слабая кислота
Н2S Û Н+ + HS- (К1 = 6 × 10-8).
в) Соли – сульфиды; соли щелочных и щелочно-земельных металлов хорошо растворимы, гидролизуются; сульфиды р-, d-металлов практически не растворимы.
г) Сульфиды металлов проявляют основную природу:
K2S + H2O Û KHS + KOH;
Сульфиды неметаллов проявляют кислотную природу:
SiS2 + 3H2O = H2SiO3 + 2H2S.
д) Тиосоли: похожи на обычные соли, в которых атомы О заменены на S:
Na2S + CS2 = Na2CS3 – тиокарбонат натрия;
Na2CS3 + 2HCl = 2NaCl + H2CS3
неустойчива
Н 2S CS2
е) Полисульфиды: сера, подобно кислороду в перекисях, может образовывать соли: Na2Sраствор + ´S = Na2Sn – полисульфид натрия (содержат сульфидные мостики – S - S - S - S -).
3. Соединения S+4
а) SO2 – сернистый газ с резким запахом, ядовит;
б) Раствор SO2 – сернистая кислота H2SO3, средней силы
H2SO3 Û Н+ + HSO3- (К1 = 1,3 × 10-2);
в) Соли – сульфиты, хорошо гидролизуются
Na2SO3 + H2O Û NaHSO3 + NaOH.
г) В окислительно-восстановительных реакциях все эти соединения проявляют двойственность:
SO2 + 2H2S = 3S + 2H2O;
о-ль
2SO2 + O2 = 2SO3.
в-ль
д) хлористый тионил: SOCl2
SOCl2 + 2H2O = H2SO3 + 2HCl.
4. Соединения S+6
а) SO3 – серный ангидрид; аллотропен, сильный окислитель. Очень энергично реагирует с водой
SO3 + H2O ® H2SO4 + 89,1 кДж/моль;
б) H2SO4 – серная кислота, бесцветная маслянистая жидкость; сильная.
H2SO4 конц. – очень сильный окислитель; обугливает бумагу, сахар, дерево:
С + 2H2SO4 конц. = СО2 +2SО2 + 2H2O.
Индивидуально её поведение с металлами:
при обыкновенной температуре со многими металлами не взаимодействует («пассивирует» Cr, Fe, Al, Zn, …);
при повышенной реагирует почти со всеми металлами, кроме Au и Pt.
Является очень хорошим водоотнимающим средством, т.к. с водой образует гидраты H2SO4 × nH2O:
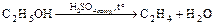 .
.
в) Соли: средние – K2SO4 (сульфаты);
кислые – KHSO4 (гидросульфаты);
купоросы – CuSO4 × 5H2O; ZnSO4 × 7H2O;
квасцы – двойные соли, кристаллогидраты
KAl(SO4)2 × 12H2O; NH4Fe(SO4)2 × 12H2O.
г) Олеум – раствор SO3 в H2SO4, при этом частично идёт реакция
2SO3 + H2O = H2S2O7 пиросерная кислота.
д) Хлористый сульфурил SO2Cl2
SO2Cl2 + 2H2O = H2SO4 + 2HCl.
е) Пероксосерные кислоты – содержат перекисные мостики
H2SO5 – пероксомоносерная,
H2S2O8 – пероксодисерная;
сильные окислители.
ж) Тиосульфаты – содержат серу в разных степенях окисления: S+6 и S-2; благодаря наличию S-2 соединения являются сильными восстановителями.
Na2S2O3 + Br2 + H2O = 2HBr + S + Na2SO4.
Соответствующая кислота Н2S2O3 (тиосерная) неустойчива:
Na2S2O3 +H2SO4 = Na2SO4 + Н2S2O3.

H2O S SO2
Элементы 7-а группы. (Галогены)
Строение электронной оболочки: …ns2np5.
9F, 17Cl, 35Br, 53J, 85At (радиоактивен). В свободном состоянии существуют в виде двухатомных молекул.
Физические свойства
Ядовиты, с резким запахом F2 – бледно-желтый газ, t°кип. = -188,2°С;
Cl2 – зелёно-жёлтый газ; t°кип. = -34,1°С;
Br2 – красная жидкость; t°кип. = 59,2°С;
J2 – фиолетовые кристаллы; t°кип. = +185,5°С.
Химические свойства
1) Самый активный – F2, в его атмосфере горят даже стекло и вода:
2F2 + SiO2 = SiF4 + O2;
2F2 + 2H2O = 4HF + O2.
2) Вышестоящие галогены (как более сильные окислители) вытесняют нижестоящие из различных соединений:
F2 + 2KCl (KBr, KJ) = 2KF + Cl2 (Br2, J2).
3) При растворении галогенов воде и растворах щелочей идут реакции диспропорционирования; в зависимости от температуры получают разные продукты реакции:
Cl2 + H2O = HCl + HClO;
Cl2 + 2NaOH = NaCl + NaClO;
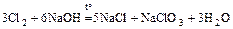 ;
;
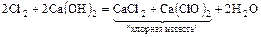 .
.
4) Галогеноводороды – все они бесцветные газы (HF благодаря водородным связям образует ассоциаты HxFx).
По ряду: HF – HCl – HBr – HJ прочность связи падает и восстановительные свойства растут:
MnO2 + 4HCl = Cl2 + MnCl2 + 2H2O ( 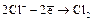 ).
).
5) При растворении в воде получают сильные кислоты; HJ – самая сильная (исключение составляет слабая фтороводородная кислота:
H2F2 Û H+ + HF2-)
6) Галогениды элементов имеют различный кислотно-основной характер, который проявляется:
а) в реакциях гидролиза
AlCl3 + H2O Û AlOHCl2 + HCl;
PBr3 + 3H2O = H3PO3 + 3HBr.
б) в реакциях комплексообразования
2NaF + SiF4 ® Na2[SiF6];
по ряду лигандов F-; Cl-; Br-; J- устойчивость комплексов уменьшается.
7) Галогены в высших степенях окисления
а) оксиды: Cl2O; (ClO2)2; (ClO3)2; Cl2O7;
б) кислоты: HClO; HClO2; HClO3; HClO4;
по ряду кислот ® сила возрастает, для кислот и их солей по этому же ряду окислительные свойства уменьшаются.
в) кислоты и их соли при нагревании разлагаются:
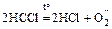 ;
;
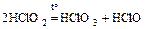 ;
;
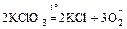 .
.
г) соединения между галогенами: их известно очень много; состав соответствует положению элементов в Периодической системе (более электроотрицательные элементы стоят в конце формул):
ClF, BrF, JF; ClF3, JF3; ClF5, ClOF3; BrF7, JO3F и др.;
имеют кислотный характер: JF7 + 4H2O = 7HF + HJO4;
ClO3F + 2NaOH = NaClO4 + NaF + H2O.
Вопросы для закрепления материала:
1.Какое вещество образуется при взаимодействии мышьяка с концентрированной азотной кислотой – а)Аs(NО3)3 ? б)H3AsO4 ? в)As2О 3?
2.Какое вещество реагирует с концентрированной кислотой с выделением свободного хлора – а)СаС12? б)МпО2? в)СrС13?
Дата добавления: 2017-10-04; просмотров: 3361;











