Аккамуляторы и топливные элементы
Применение электрохимических устройств и прцессов весьма многообразно. Прежде всего - это химические источники тока - гальванические элементы и аккумуляторы. Последние отличаются от обычных ГЭ тем, что это - обратимо работающие устройства. После расходования реагентов на получение электрической энергии эти реагенты регенерируются при пропускании тока; при этом происходят реакции, обратные тем, что протекают в первом режиме. Из наиболее широко используемых рассмотрим работу свинцового кислотного аккумулятора, который используется в автомобилях и автобусах. В основе его действия лежит электрохимическая цепь:
(-) Pb | PbSO4 к ║H2SO4 р║ PbO2 к | Pb (+) .
Разрядка происходит за счет следующих полуреакций:
анод: Pb - 2ē + + SO42- = PbSO4 (к)
катод:PbO2 (к) + 2ē + 4Н+ + SO42- = PbSO4 (к) + Н2О
 |
токообр. реакцияPbк + PbO2 к + 2H2SO4 р = 2PbSO4 к + Н2О.
Зарядка аккумулятора происходит по обратным реакциям - реакциям электролиза.
Другой разновидностью химических источников электрической энергии являются топливные элементы.Это устройства, в которых в качестве реагентов используются топлива (Н2 , С, СН4 и др.). Преимуществом топливного ГЭ является высокий КПД, достигающий 90 %, в то время как в обычном топливно-энергетическом цикле он обычно менее 40 %. Если в качестве топлива взять Н2, окислителя - О2 и электролита КОН (водородно-кислородный элемент), то на электродах протекают процессы:
анод:Н2 + 4ОН- - 4ē = 4Н2О;
катод: О2 + 2Н2О + 4ē = 4ОН-.
Токообразующая реакция:
2Н2 (г) + О2 (г) = 2Н2О ж , DG0298 = -574 кДж.
ЭДС в таком элементе можно вычислить по формуле (7.4):
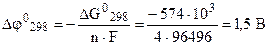 .
.
Подобные топливные элементы не получили пока широкого распространения из-за ряда технических проблем, но разработка их проводится весьма интенмивно. Известно, что на космических кораблях серии «Аполлон», на которых проводились полеты на Луну использовались топливные элементы. Сообщается также об опытных образцах автомобилей, в которых используют топливные элементы.
Электролиз растворов и расплавов широко используют в промышленности (например, при получении металлов), в том числе и для синтеза некоторых соединений (например, как показано выше, можно получать производные Н2S2О8). Кроме того, он используется для очистки металлов электролизом растворов; очистка основана на разных скоростях осаждения разных металлов; для этих же целей используется электролиз растворов с растворимым анодом.
Широкое использование находят электрохимические реакции в различных измерительных приборах (образцовые гальванические элементы, электрические методы анализа – рН-метрия, кондуктометрия, полярография и др.).
Дата добавления: 2016-07-05; просмотров: 2798;











