ОСНОВНЫЕ СВОЙСТВА d- ЭЛЕМЕНТОВ
Это металлы побочных подгрупп больших периодов; валентные электроны находятся на s – орбиталях внешнего электронного уровня и d – орбиталях предвнешнего уровня. Для этого семейства характерны следующие признаки:
1. Большинство элементов в соединениях проявляют различные степени окисления (исключение - цинк).
2. Многие соединения имеют окраску.
3. Элементы характеризуются высокой комплексообразующей способностью.
4. Если элемент образует соединения, проявляя разные степени окисления, то это часто связано с их различными кислотно-основными свойствами:
а) минимальная с.о. – основные свойства (Cr+2, Fe+2, Mn+2 );
б) промежуточная с.о. – амфотерные свойства (Cr+3, Fe+3, Mn+4);
в) максимальная с.о. – кислотные свойства (Cr+6, Fe+6, Mn+7).
5. В зависимости от степени окисления соединения по-разному ведут себя в окислительно-восстановительных реакциях:
а) если у элемента минимальная с.о., то соединения – восстановители;
б) если у элемента промежуточная с.о., то соединения – redox-амфолиты;
в) если у элемента максимальная с.о., то соединения – окислители.
ПОДГРУППА МЕДИ
Физические свойства: все элементы электропороводны, пластичны, находят широкое применение в технике и медицине.
Таблица 6
Свойства элементов подгруппы меди
| Элемент | Строение валентных орбиталей | Степени окисления | Плотность (г/см3) | t°пл, С |
| Медь 29Сu Серебро 47Ag Золото 79Au | …3d104s1 …4d105s1 …5d106s1 | +1 +2 +3 +1 +2 +3 +1 +2 +3 | 8,96 10,5 19,3 |
Химические свойства
Малоактивны, что соответствует их положению в ряду активности металлов: …Н, Cu, Hg, Ag, Au.
1.2Cu + O2 = 2CuO (или Cu2O)
Ag + O2 ¹
Au + O2 ¹
2. Cu, Ag, Au + H2 ¹
3. Cu + Cl2 = CuCl2
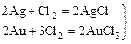 реакции идут медленно
реакции идут медленно
4. Взаимодействие с кислотами:
а) Н2SO4 конц.: Cu + 2Н2SO4 = CuSO4 + SO2 + 2H2O;
2Ag + 2Н2SO4 = Ag2SO4 + SO2 + 2H2O;
Au + Н2SO4 ¹.
б) НNO3 конц; Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O;
Ag + 2HNO3 = AgNO3 + NO2 + H2O;
Au + HNO3 ¹.
в) НNO3 разб; 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O;
6Ag + 8HNO3 = 6AgNO3 + 2NO + 4H2O;
Au + HNO3 ¹.
г) «царская водка» - смесь НNO3 конц и НCl конц
Au + HNO3 + 3HCl = AuCl3 + NO + 2H2O
или
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O.
Индивидуальные свойства меди
Сu+: а) Cu2О – закись меди, неустойчива; красный порошок
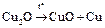 .
.
б) Соли тоже диспропорционируют:
2CuCl ® CuCl2 + Cu.
в) Комплексные соединения растворимы лучше средних солей; образуются легко:
CuCl + KCl ® K[CuCl2]; или K2[CuCl3], K3[CuCl4];
CuCl + 2NH3 ® [Cu(NH3)2]Cl.
Сu2+: а) CuО – окись меди, чёрные кристаллы
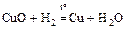 ;
;
б) Cu(OH)2 – голубой осадок; амфотерность практически не проявляется;
в) соли устойчивы, сине-зелёного цвета
CuSO4 × 5H2O – медный купорос;
(CuОН)2СО3 – малахит.
Хорошо вступают в реакции комплексообразования:
CuSO4 + 4NH4OH ® [Cu(NH3)4]SO4 + 4H2O.
голубой ярко-синий
Индивидуальные свойства серебра
Малоактивно, но на воздухе чернеет, т.к. идёт реакция:
4Ag + 2H2S + O2 = 2Ag2S¯ + 2H2O.
Ag+: а) Ag2O – чёрный; 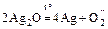 ;
;
б) 2AgNO3 + 2NaOH = 2NaNO3 + Ag2O¯+ H2O;
в) Большинство солей нерастворимы в воде, но растворяются, переходя в комплексные соединения
AgCl¯ + 2NH4OH ® [Ag(NH3)2]Cl + 2H2O;
AgBr¯ + Na2S2O3 ® Na[AgS2O3] + NaBr;
AgJ¯ + KJ ® K[AgJ2].
Ag2+: Известны AgO, AgF2; соединения неустойчивы.
Ag3+: Ag2O3, K[AgF4].
Все соединения – окислители и могут восстанавливаться до свободного серебра:
AgF2 + Zn = Ag + ZnF2.
Индивидуальные свойства золота
Золото – самое неактивное из металлов подгруппы, его соединения легко восстанавливаются до золота, которое существует в виде коллоида красного или розового цвета (т.н. «кассиев пурпур»).
Au+:Au2O, AuCl.
Au3+: а) Au2O3, Au(OH)3 – неустойчивы:
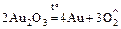 ;
;
б) AuCl3, AuBr3 в воде растворимы;
в) соединения чаще встречаются в виде комплексных соединений
Au(OH)3 + NaOH ® Na[Au(OH)4];
Au(OH)3 + 4HNO3 ® H[Au(NO3)4] + 3H2O;
AuCl3 + HCl ® Н[AuCl4];
г) окислительные свойства соединений
2AuCl3 + 3SnCl2 = 2Au¯ + 3SnCl4.
ПОДГРУППА ЦИНКА
Таблица 7
Свойства элементов подгруппы цинка
| Элемент | Строение валентных орбиталей | Плот-ность (г/см3) | t°пл, С | Степени окисления | Координаци-онные числа |
| Цинк 30Zn Кадмий 48Cd Ртуть 80Hg | …3d104s2 …4d105s2 …5d106s2 | 7,1 8,7 13,55 | -39 | +2 +2 +1 +2 | 2, 4, 6 |
Химические свойства
В ряду напряжений их местоположение связано с химической активностью: …Zn…Cd…H, Cu, Hg…
Индивидуальные свойства цинка
1. Цинк – самый активный металл подгруппы
а) Zn + 2HCl = ZnCl2 + H2;
б) 3Zn + 4H2SO4 конц. = 3ZnSO4 + S¯ + 4H2O;
в) 5Zn + 12HNO3 разб. = 5Zn(NO3)2 + N2 + 6H2O.
2. В то же время Zn, ZnO, Zn(OH)2 амфотерны:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2;
ZnO + 2HCl = ZnCl2 + H2О;
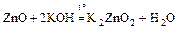 ;
;
Zn(OH)2¯ + 2HNO3 = Zn(NO3)2 + 2H2O;
Zn(OH)2¯ + 2KOH = K2[Zn(OH)4].
3. Соли гидролизуются, например раствор «цинкового купороса»
ZnSO4 × 7H2O имеет кислую среду:
2ZnSO4 + 2H2O Û (ZnOH)2SO4 + H2SO4
Zn2+ + H2O Û ZnOH+ + H+.
Индивидуальные свойства ртути
Из различных соединений ртути наиболее токсичны: ртуть металлическая Hg и соединения ртути (II).
Hg+ (существует в виде иона 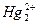 ); соединения малоустойчивы.
); соединения малоустойчивы.
а) Hg2O – закись ртути, чёрная;
б) Hg2Cl2 – каломель; Hg2(NO3)2 и др.
для многих соединений характерны реакции диспропорционирования:
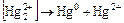 .
.
в) гидроксид неустойчив:
Hg2(NO3)2 + 2КОН = 2КNO3 + Hg2O¯ + Н2О.
г) соли проявляют окислительно-восстановительную двойственность:
Hg2Cl2 + Cl2 = 2HgCl2 ( 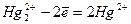 );
);
в-ль
Hg2Cl2 + SnCl2 = 2Hg + SnCl4 ( 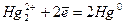 ).
).
о-ль
Hg2+: а) HgO – окись ртути, жёлтая, красная;
б) гидроксид неустойчив:
Hg(NO3)2 + 2КОН = 2КNO3 + HgO¯ + Н2О.
в) из солей часто используют: HgCl2 – сулема; HgS – киноварь.
ХРОМ
24Cr…4s13d5.
Физические свойства
Один из самых твёрдых металлов; режет стекло. Плотность 7,2 г/см3;
t°пл. = 1890°С.
Химические свойства
1. При обычной температуре устойчив, при повышенной взаимодействует со многими элементами:
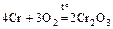 ;
;
2Cr + 3Cl2 = 2CrCl3;
2Cr + N2 = 2CrN.
2. Взаимодействует со сложными веществами
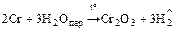
Поверхность металла обычно покрыта оксидной плёнкой, которая его «пассивирует» и поэтому при комнатной температуре хром не взаимодействует с HNO3 конц. и H2SO4 конц., но идут реакции
Cr + 2HClразб. = CrCl2 + H2;
Cr + H2SO4 разб. = CrSO4 + H2.
Полученные соли неустойчивы и переходят в CrCl3 и Cr2(SO4)3.
3. В соединениях хром проявляет следующие степени окисления:
Таблица 8
Наиболее важные соединения хрома
| +2 | +3 | +6 | ||||||||
| CrO основной оксид Cr(OH)2 CrCl2, CrSO4 соединения малоустойчивы | Cr2O3 – амфотерен
Cr(OH)3 (H3CrO3), K3CrO3 ортохромиты CrCl3 (HСrO2), KСrO2 метахромиты | CrO3 – кислотный оксид H2CrO4 – хромовая кислота Me2CrO4 - хроматы H2Cr2O7 - двухромовая Me2Cr2O7 - дихроматы | ||||||||
| восстановители | восстановители и окислители | Окислители |
Как правило Cr2+ ® Cr3+; например самопроизвольно при стоянии идет окисление: 4Cr(OH)2¯ + O2 + 2H2O ® 4Cr(OH)3¯.
Для соединений характерна богатая окраска :
| CrO чёрный Cr(OH)2 жёлтый CrCl2 голубой | Cr2O3 – серо-зелёный NaCrO4 – ярко зелёный K3[CrCl6] – розовый K3[Cr(SO4)3] – жёлтый | CrO3 – красный H2CrO4 – жёлтый H2Cr2O7 - оранжевый |
4. Известны перекисные соединения хрома:
CrO5, H2CrO6, соли – синие;
H3CrO8, соли – красные.
МАРГАНЕЦ
25Mn…4s23d5
Физические свойства
Тяжёлый, серебристо-белый металл. Плотность 7,44 г/см3; t°пл. = 1245°С.
Химические свойства
Активен и поэтому покрыт оксидной плёнкой, которая защищает его.
1. Взаимодействует со многими элементами
Mn + O2 = MnO2;
Mn + Cl2 = MnCl2 (или MnCl4);
Mn + C = MnC.
2. Реакции со сложными веществами:
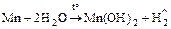 ;
;
Mn + 2HCl. ® MnCl2 + H2;
Mn + 2H2SO4 конц. = MnSO4 + SO2 + 2H2O;
3Mn + 8HNO3 конц. = 3Mn(NO3)2 + 2NO + 4H2O.
3. В соединениях проявляет степени окисления: +2, +3, +4, +5, +6, +7.
Наиболее часто встречающиеся соединения марганца представлены ниже:
Таблица 9
Наиболее важные соединения марганца
| +2, +3 | +4 | +6, +7 | ||||||||
| основной характер MnO Mn2O3 Mn(OH)2 - неуст. MnSO4 | амфотерны
MnO2, MnO(OH)2
Mn(OH)4 K4MnO4 Mn(SO4)2 K2MnO3 манганиты | Кислотный характер H2MnO4 Mn2O7 K2MnO4 HMnO4 манганаты KMnO4 соли-пер- манганаты | ||||||||
| соединения Mn2+ - восстановители | Mn4+ – redox-амфотерен | соединения Mn7+ - окислители |
При стоянии Mn2+ ® Mn4+ : 2Mn(OH)2¯ + O2 + 2H2O ® 2Mn(OH)4¯.
4. Перманганат калия KMnO4 применяется как сильный окислитель в аналитической химии, медицине. В зависимости от среды даёт различные продукты реакции:
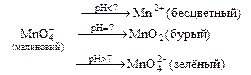
ЖЕЛЕЗО
26Fe…4s23d6
Физические свойства
Серебристо-белый металл, пластичный, электропроводный, легко намагничивается. Плотность 7,87 г/см3; t°пл. = 1539°С.
Химические свойства
1. Вступает в реакции с простыми веществами:
3Fe + 2O2 = Fe3O4 (FeO × Fe2O3);
2Fe + 3Cl2 = 2FeCl3;
Fe + S = FeS;
Fe + P = FeP.
2. Взаимодействует со сложными веществами
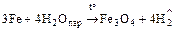 ;
;
Fe + 2HCl. = FeCl2 + H2;
Fe + 2H2SO4 разб. = FeSO4 + H2;
Fe + 4HNO3 разб. = Fe(NO3)3 + NO + 2H2O;
Fe + HNO3 конц. ¹ пассивируется;
2Fe + 6H2SO4 конц. 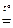 Fe2(SO4)3 + 3SO2 + 6H2O;
Fe2(SO4)3 + 3SO2 + 6H2O;
Fe + PbSO4 = Pb + FeSO4.
3. В соединениях железо проявляет различные степени окисления:
Таблица 10
Наиболее важные соединения железа
| +2 | +3 | +6 |
| FeO основные свойства Fe(OH)2 - неустойчив FeSO4 | Fe2O3 – в основном основные свойства, амфотерность только при сплавлении Fe(OH)3 KFeO2 FeCl3 феррит получить трудно | K2FeO4, BaFeO4 ферраты неустойчивы |
| восстановители | redox-амфолиты ? | окислители |
Под действием кислорода воздуха Fe(OH)2¯ ® Fe(OH)3¯.
4. Соли Fe2+ - жёлто-зелёные;
Соль Мора: (NH4)2Fe(SO4)2 × 6Н2 О
Соли Fe3+ - жёлто-оранжевые;
железо-аммонийные квасцы: KFe(SO4)2 × 12H2O; устойчивы при хранении.
5. Реакции открытия соединений железа:
а) качественная реакция на ион Fe2+ - реакция с «красной кровяной солью» K3[Fe(CN)6]
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2¯ + 3K2SO4.
тёмно-синий
б) качественные реакции на ион Fe3+
FeCl3 + 3KSCN = Fe(SCN)3 + 3KCl;
тёмно-красный
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3¯ + 12KCl.
тёмно-синий
КОБАЛЬТ
27Со…4s23d7; по физическим и химическим свойствам похож на железо, но менее активен. В соединениях проявляет степени окисления +2, +3
+2: СоО, Со(ОН)2; средние соли весьма устойчивы, как правило розового цвета. Под действием сильных окислителей Со2+ ® Со3+:
2Со(OH)2 + NaClO + H2O ® 2Co(OH)3 + NaCl.
+3: Со(ОН)3; средние соли малохарактерны, но комплексные соли известны [Co(NH3)6]Cl3; K3[Co(NO2)6].
Реакция открытия:
СоCl2 + 4NH4SCN ® (NH4)2[Co(SCN)4] + 2NH4Cl.
розовый в ацетоне ярко-голубой
НИКЕЛЬ
28Ni… 4s23d8; по физическим и химическим свойствам похож на Fe. В соединениях проявляет степени окисления +2, +3. (Степень окисления +3 для Ni ещё менее характерна, чем для Со).
Известны соединения NiO, 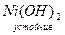 , средние соли (зелёного цвета), комплексные соли с к.ч. = 4, 6: K2[Ni(CN)4]; [Ni(NH3)6]Cl2.
, средние соли (зелёного цвета), комплексные соли с к.ч. = 4, 6: K2[Ni(CN)4]; [Ni(NH3)6]Cl2.
Реакция открытия:
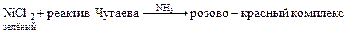
Вопросы для закрепления материала:
1.В чем можно растворить медную пластинку – а)в НС1? б)в растворе NаОН? в)в концентрированной НNO3 ?
2.Какого состава хлорид получится при нагревании хрома с хлором – а)CrCI2? б)CrCI3? в)CrCI6?
Дата добавления: 2017-10-04; просмотров: 1916;