Законы термодинамики в холодильной технике
1. Первый закон термодинамики является частным случаем закона сохранения энергии, согласно которому, энергия не исчезает и не возникает вновь, а только переходит из одного вида в другой. Он формулируется так: вся теплота, подведенная к веществу, расходуется на изменение его внутренней энергии и на совершение веществом внешней работы.
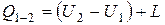 ,
,
где 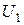 ,
, 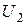 - соответственно внутренняя энергия в начале и конце процесса, Дж,
- соответственно внутренняя энергия в начале и конце процесса, Дж, 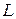 - работа, совершенная веществом в процессе, Дж.
- работа, совершенная веществом в процессе, Дж.
Удельная теплота процесса:
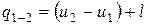 .
.
При изобарных процессах, когда p=const:
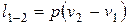 ,
,
где 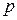 - абсолютное давление, Па,
- абсолютное давление, Па, 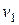 ,
, 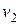 - соответственно удельные объемы вещества в начале и конце процесса, м3/кг.
- соответственно удельные объемы вещества в начале и конце процесса, м3/кг.
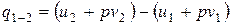 .
.
При анализе и расчетах термодинамических процессов, используют функцию состояния вещества называемую энтальпией:
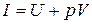 .
.
Энтальпия – это полная энергия рабочего вещества в открытой системе, которая получена веществом и расходуется на изменение внутренней энергии вещества и на совершение им работы.
Удельная энтальпия:
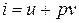 ,
,
где 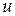 - удельная внутренняя энергия, Дж/кг,
- удельная внутренняя энергия, Дж/кг, 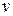 - удельный объем, м3/кг.
- удельный объем, м3/кг.
Для адиабатического процесса, первый закон термодинамики запишется в виде:
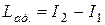 ,
,
для изобарного процесса (например, кипение или конденсация):
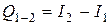
2. Второй закон термодинамики – устанавливает, что теплота не может самопроизвольно переходить от системы с меньшей температурой к системе с большей температурой. Это можно выполнить, затратив механическую работу или эквивалентное количество другой энергии.
Направление процесса теплообмена системы с окружающей средой, а также любых самопроизвольных процессов в изолированной системе, характеризуется параметром состояния – энтропией. Она определяется дифференциалом энтропии ( 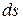 ) как отношение бесконечно малого количества сообщенной теплоты,
) как отношение бесконечно малого количества сообщенной теплоты, 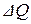 к абсолютной температуре
к абсолютной температуре 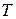 , при которой происходит термодинамический процесс.
, при которой происходит термодинамический процесс.
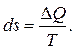
Термодинамические процессы могут быть обратимыми, необратимыми и круговыми.
Круговой процесс или цикл – процесс, при котором система из некоторого начального состояния, после ряда изменений, возвращается в то же состояние.
Обратимый процесс допускает возможность возвращения системы в первоначальное состояние, без каких либо изменений в окружающей среде.
Условия превращения теплоты в работу и направленность тепловых процессов, соответствующих второму закону термодинамики, выражаются соотношениями:
для обратимого процесса:
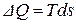 ;
;
для необратимого процесса:
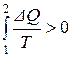 .
.
Общий вид уравнения для обратимого процесса следующий:
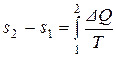 .
.
Согласно второму закону термодинамики, можно сказать, что для адиабатических изолированных систем, суммарное изменение энтропии 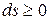 , для неизолированных систем
, для неизолированных систем 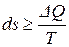 . Знак равенства относится к обратимым процессам, неравенство – к необратимым. В обратимых процессах
. Знак равенства относится к обратимым процессам, неравенство – к необратимым. В обратимых процессах 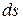 и
и 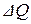 имеют одинаковый знак, таким образом, по изменению энтропии можно судить о направлении процесса теплопереноса. Если энтропия растет, то происходит подвод теплоты, если уменьшается, то теплота отводится. Если энтропия не меняется, то процесс адиабатический, т.е. без теплообмена с окружающей средой.
имеют одинаковый знак, таким образом, по изменению энтропии можно судить о направлении процесса теплопереноса. Если энтропия растет, то происходит подвод теплоты, если уменьшается, то теплота отводится. Если энтропия не меняется, то процесс адиабатический, т.е. без теплообмена с окружающей средой.
Объединенное уравнение первого и второго законов термодинамики можно записать:
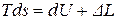 .
.
Дата добавления: 2017-09-01; просмотров: 2563;











