Реальные газы и жидкости
Лекция 16
Отступление реальных газов от законов для идеальных газов. Взаимодействие молекул. Уравнение Ван-дер-Ваальса и его анализ. Критическое состояние. Экспериментальные изотермы реального газа. Сопоставление изотерм Ван-дер-Ваальса с экспериментальными изотермами.
Реальные газы при не слишком высоких давлениях и при не слишком низких температурах хорошо подчиняются газовым законам. При увеличении давления наблюдаются значительные отклонения от этих законов. При увеличении давления увеличивается плотность газа, при этом уменьшается среднее расстояние между молекулами. В таких условиях все большую роль начинает играть собственный объем молекул и взаимодействие между ними, что не учитывалось при получении уравнения Клапейрона-Менделеева и газовых законов.
Если учесть размеры молекул и силы притяжения между ними, то можно ввести соответствующие поправки в уравнение Клапейрона-Менделеева и получить уравнение состояния реального газа.
Объем, в котором могут двигаться молекулы меньше геометрического объема сосуда V на некоторую величину b, пропорциональную собственному объему молекул. Поправка b учитывает наличие сил отталкивания между молекулами.
Кроме сил отталкивания надо учитывать наличие сил притяжения между молекулами. Силы притяжения приводят к возникновению добавочного давления ∆p, которое называется молекулярным давлением.
С учетом поправок на силы притяжения и отталкивания уравнение состояния для 1 моля реального газа примет вид:
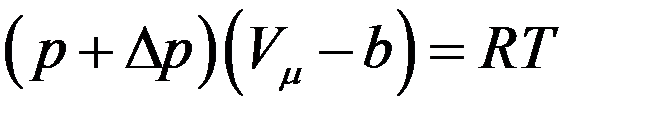 (1)
(1)
где Vµ - объем 1 моля газа.
Определим величину молекулярного давления ∆p. Рассмотрим молекулы, которые находятся у стенки сосуда. На эти молекулы действует сила притяжения со стороны молекул, находящихся вдали от стенки. Эта сила направлена внутрь сосуда, и она уменьшает давление газа на стенку. Число внутренних молекул, а значит и сила, которая действует со стороны их, на каждую пристеночную молекулу пропорциональна числу молекул в единице объема n. Число молекул, находящихся у стенки сосуда также пропорционально концентрации n. Следовательно, сила, с которой внутренние молекулы действуют на пристеночные молекулы, пропорциональна n2:
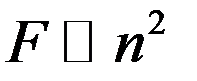
Известно, что:
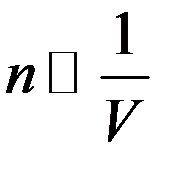
Значит величина силы, действующей на пристеночные молекулы:
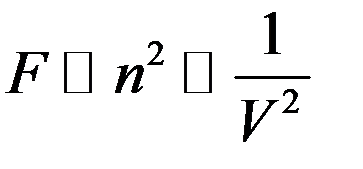
Эта сила уменьшает давление на стенку сосуда на величину ∆p:
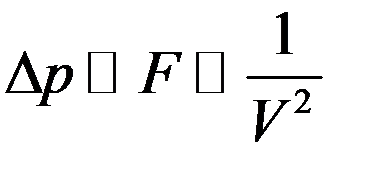
Или:
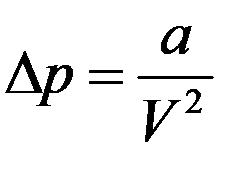 (2)
(2)
где a – коэффициент пропорциональности, зависящий от рода газа.
С учетом (2) из (1) получим уравнение состояния 1 моля реального газа:
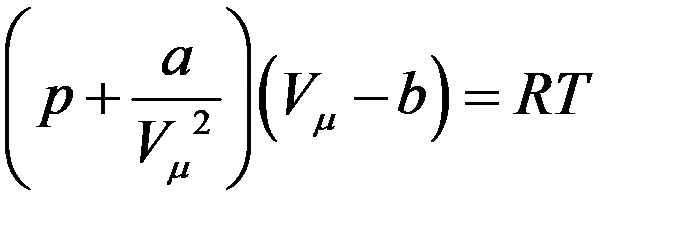 (3)
(3)
где Vµ - объем 1 моля газа.
Уравнение (3) получил в 1873 году голландский физик Ван-дер-Ваальс, и оно носит его имя.
Учтем, что:
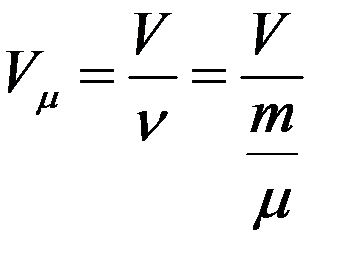 (4)
(4)
где V – объем ν молей газа, ν = m/µ - число молей.
С учетом (4) из (3) получим уравнение Ван-дер-Ваальса для произвольной массы газа:
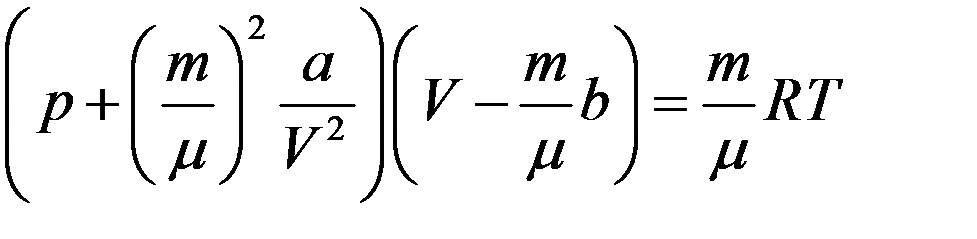 (5)
(5)
Постоянные a и b для каждого газа определяются опытным путем. Уравнение (5) значительно лучше описывает состояние реального газа, чем уравнение Клапейрона-Менделеева.
Определим величину поправки b. Две молекулы могут сблизиться на расстояние не меньше, чем сумма их радиусов (рис.1).
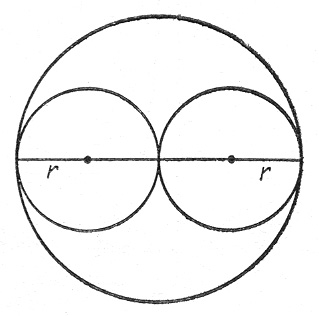
Рис.1. К выводу значения поправки на объем молекул
Очевидно, что из всего объема, который занимает газ необходимо исключить некоторую часть b, пропорциональную объему сферы с радиусом 2r и числу сталкивающихся молекул:
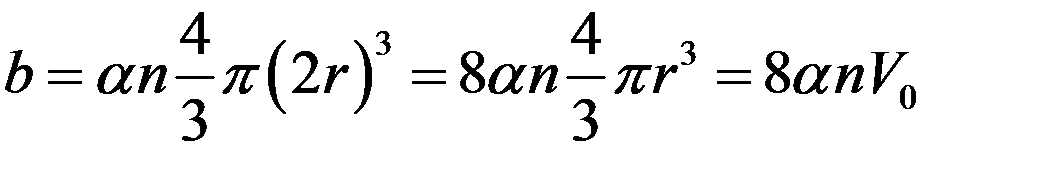
где:
 ,
,
собственный объем молекулы, n – концентрация молекул, α - коэффициент, учитывающий число сталкивающихся молекул. Он равен ½, т.к. в большинстве случаев одновременно сталкивается две молекулы. С учетом этого:
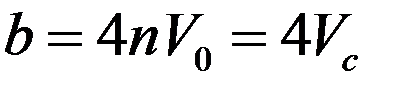
где Vc – собственный объем молекул в единице объема.
Преобразуем уравнение (3). Обозначим объем 1 моля газа просто V и раскроем скобки:
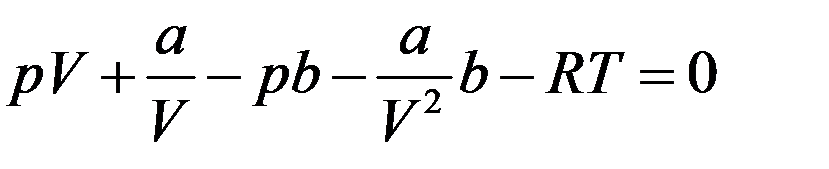
Умножим обе части на V2:
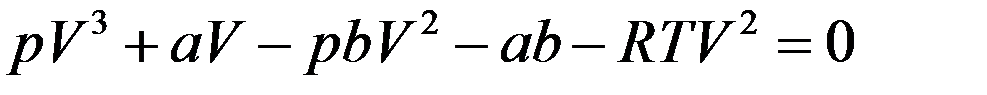
Разделим обе части на p и перегруппируем члены:
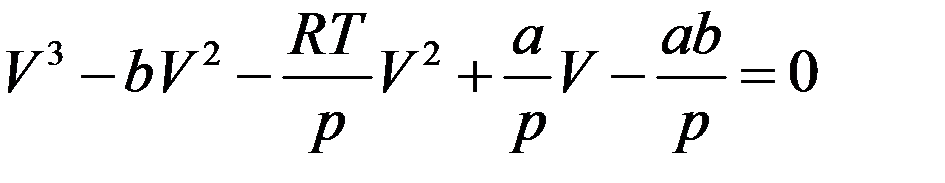
Или:
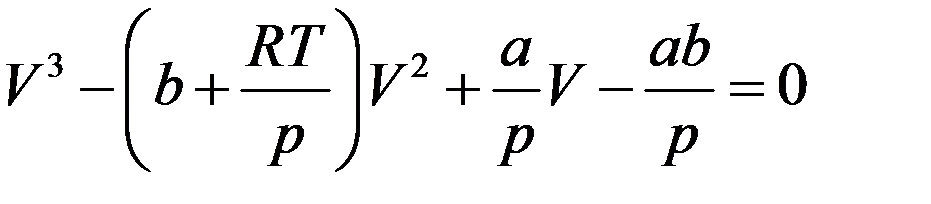 (6)
(6)
Уравнение третей степени относительно V имеет либо три вещественных корня, либо один. Каждому корню на плоскости p,V соответствует точка, в которой изобара (p = const) пересекает изотерму Ван-дер-Ваальса. Если уравнение (6) имеет три корня, то каждому значению давления p и температуры T соответствует три значения объема V1, V2, и V3 (рис.2).
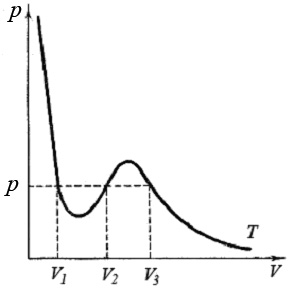
Рис.2. Изотерма Ван-дер-Ваальса
Теоретические кривые, которые соответствуют уравнению (6), построенные при разных температурах называются изотермами Ван-дер-Ваальса (рис.3).
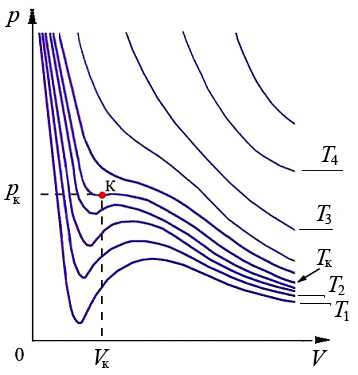
Рис.3. Изотермы Ван-дер-Ваальса. T1<T2<Tк<T3<T4.
При высоких температурах T3, T4 изотермы Ван-дер-Ваальса практически не отличаются от изотерм идеального газа. При понижении температуры на изотермах появляются изгибы, которые увеличиваются при дальнейшем понижении температуры (рис.3). В этих областях температур каждому значению давления соответствует три значения объема. Это значит, что все три корня уравнения (6) вещественные.
При повышении температуры точки V1, V2, V3, которые соответствуют решениям (6) сближаются и при некоторой температуре, разной для различных веществ, сливаются в одну точку. Это значит, что корни уравнения (6) становятся кратными и совпадают. Эта точка называется критической точкой (К). Соответствующие этой точке значения давления, объема и температуры называются критическими (pк, Vк, Tк) (рис.3).
Значения pк, Vк, Tк разные для разных веществ. Их можно однозначно определить через постоянные a и b уравнения Ван-дер-Ваальса. Для критического состояния все корни (6) равны:
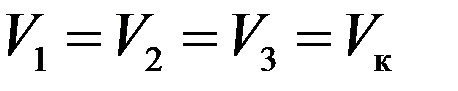
Следовательно, должно выполняться равенство:
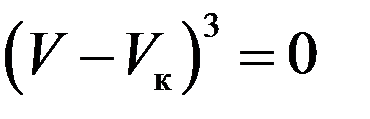
Или:
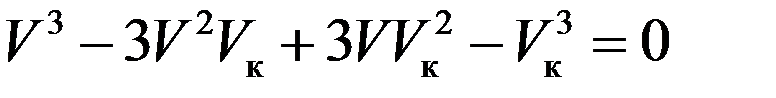 (7)
(7)
Уравнение (7) должно быть тождественно уравнению (6) если в нем p = pк и T = Tк:
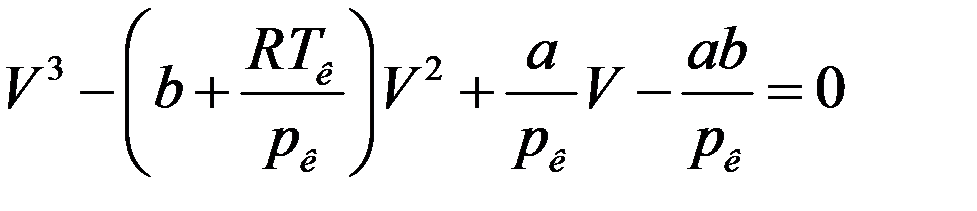 (8)
(8)
(7) и (8) тождественны, если коэффициенты при V равные:
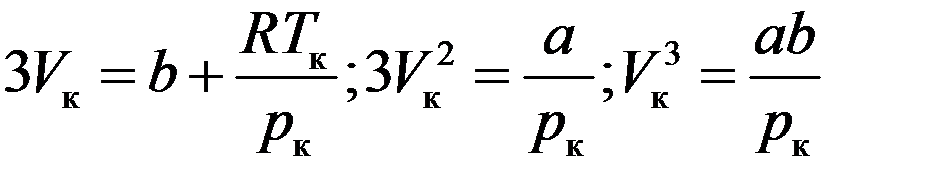 (9)
(9)
Разделим третье уравнение в (9) на второе:
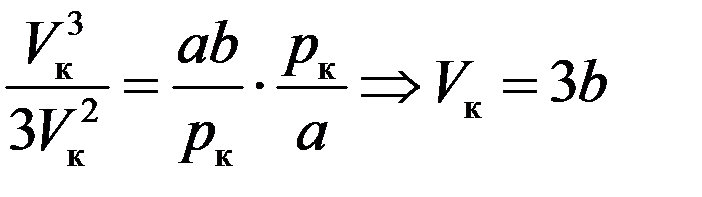
Подставим Vк во второе уравнение (9):
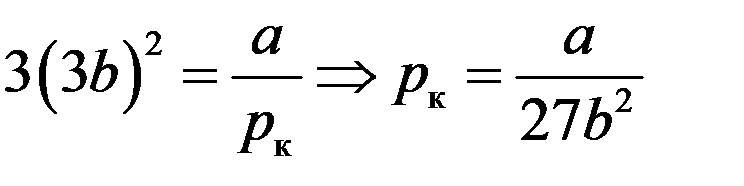
Подставим pк и Vк в первое уравнение (9):
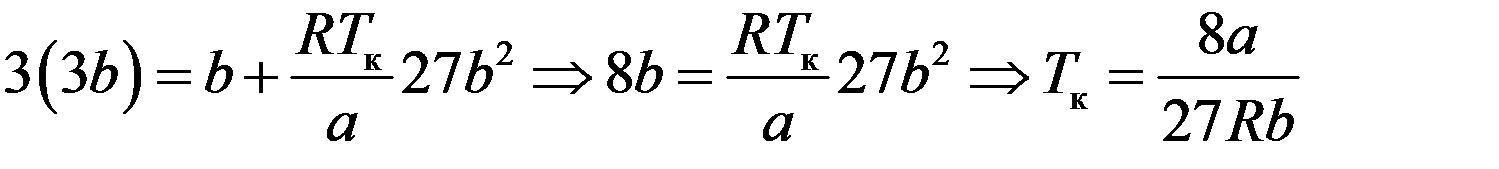
Таким образом, критические параметры определяются выражениями:
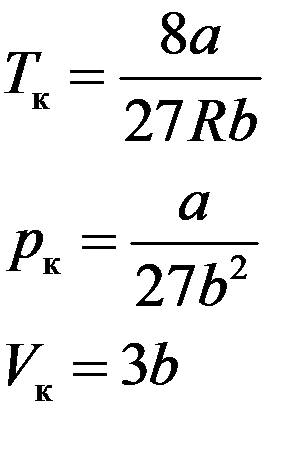 (10)
(10)
Изотермы для одной и той же температуры будут разные для разных газов, т.к. постоянные a и b и связанные с ними критические параметры разные для разных газов. Используя приведенные параметры можно получить уравнение Ван-дер-Ваальса не зависящее от рода газа. Приведенными параметрами называются отношения:
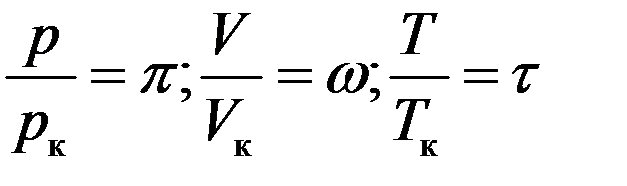
Отсюда следует:
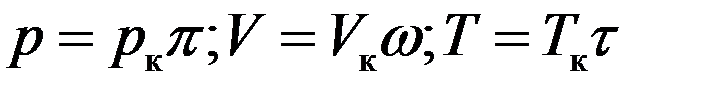
Или:
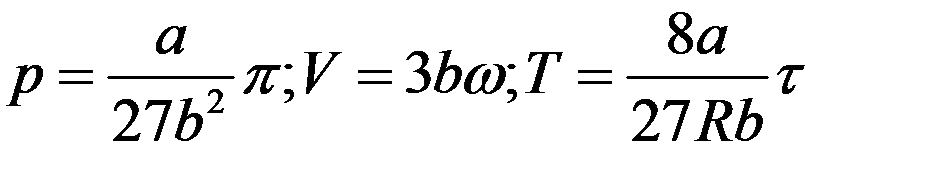 (11)
(11)
Подставив (11) в уравнение Ван-дер-Ваальса:
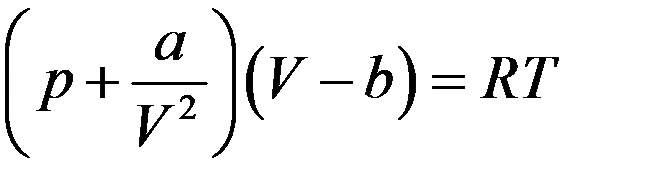 ,
,
получим:
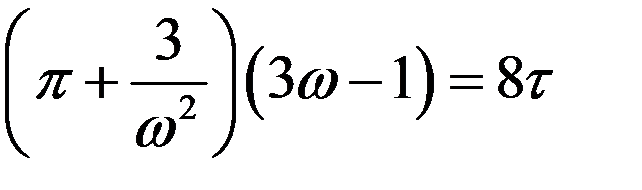 (12)
(12)
Из (12) следует, что если разные вещества находятся в состоянии с двумя одинаковыми приведенными параметрами из трех, то и третий параметр будет также одинаковый.
При температурах ниже критической между теоретическими изотермами Ван-дер-Ваальса и изотермами, полученными экспериментально, наблюдаются значительные расхождения. Первые экспериментальные изотермы были получены Эндрюсом в 1866 году при изотермическом сжатии углекислого газа (рис.4).
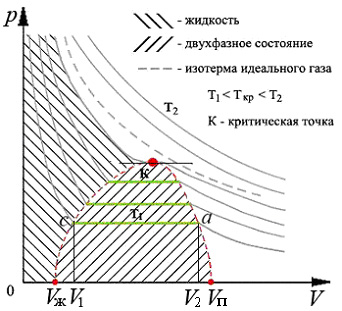
Рис.4. Изотермы реального газа
При высоких температурах экспериментальные и теоретические изотермы практически одинаковые. При низких температурах уменьшение объема сначала также сопровождается ростом давления. При уменьшении объема до некоторого значения V2 давление перестает увеличиваться, несмотря на уменьшение объема (точка a). При этом сжимаемый газ перестает быть однородным, часть его конденсируется в жидкость. При дальнейшем уменьшении объема все большая часть газа переходит в жидкое состояние, давление при этом не изменяется – линия a-c (рис. 4). При уменьшении объема до V1 газ полностью переходит в жидкое состояние (точка c). Дальнейшее уменьшение объема сопровождается резким увеличением давления, что обусловлено очень малой сжимаемостью жидкости.
Таким образом, вместо S – образного участка теоретической изотермы Ван-дер-Ваальса, экспериментальные изотермы имеют горизонтальный участок a – c, который соответствует разделению вещества на две фазы: жидкую и газообразную. На этом участке имеет место равновесие между жидкой и газообразной фазами вещества.
Газ или пар, находящийся в равновесии со своей жидкостью называется насыщенным паром. Давление при данной температуре, при котором пар становится насыщенным, называется давлением или упругостью насыщенного пара. Величина давления насыщенного пара зависит только от температуры и не зависит от занимаемого объема.
При повышении температуры горизонтальные участки (изобары насыщенного пара), которые соответствуют двухфазному состоянию, уменьшаются. Это происходит потому, что с ростом температуры удельный объем насыщенного пара уменьшается, точка a сдвигается влево, а удельный объем жидкости увеличивается, точка c сдвигается вправо, (плотность жидкости уменьшается, а плотность пара увеличивается).
Удельным объемом называется объем единицы массы вещества:
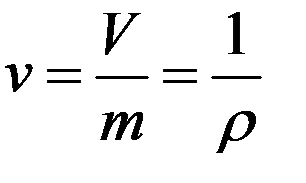
При некоторой температуре (31,1oC для CO2) точки a и c сливаются в точку К, при этом исчезает разница между жидким и газообразным состоянием вещества.
При некоторых, специальных условиях можно получить состояния, соответствующие участкам c-d и a-f теоретических изотерм Ван-дер-Ваальса (рис.5):
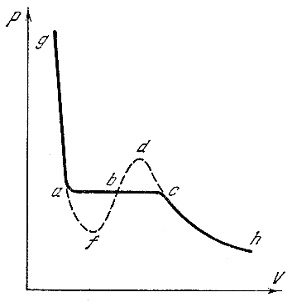
Рис.5. Теоретическая и экспериментальная изотермы реального газа
Например, участок c-d можно получить при сжатии газа, или при резком охлаждении сосуда с воздухом, содержащим пары воды. При этом газ (воздух) должен быть очищен от пыли, ионов и т.д. (центры конденсации). При этих условиях, несмотря на охлаждение и уменьшение, таким образом, упругости насыщенного пара воды, пар может не конденсироваться некоторое время, оставаясь в газообразном состоянии. Такой пар называется пересыщенным. Однако такое состояние неустойчивое. В конце концов, конденсация начинается, давление скачком уменьшается до давления насыщенного пара при данной температуре.
При изотермическом расширении жидкости можно получить задержку в появлении пара – участок a – f, несмотря на то, что давление пара будет меньше, чем давление насыщенного пара при данной температуре. Это состояние неустойчивое (метастабильное). Оно называется состоянием растянутой или перегретой жидкости. Перегретой в смысле того, что при данных значениях температуры и объема часть жидкости должна находиться в парообразном состоянии, в то время как пар отсутствует. Состояния, которые соответствуют участкам f-b-d изотермы Ван-дер-Ваальса, вообще не могут существовать. При этих условиях вещество должно обладать неестественными свойствами: при уменьшении объема, давление должно уменьшаться и наоборот.
При некоторой температуре Tк горизонтальная линия, которая соответствует двухфазной системе, стягивается в точку (точка перегиба кривой). При этой температуре, разной для разных веществ, исчезает разница между жидким и газообразным состояниями. Это состояние называется критическим состоянием. Критическая температура гелия – 4K, воды – 374оC. В критической точке каждое вещество характеризуется критическими параметрами. Например, для воды: Tк = 374 оC, pк = 218 атм., Vк = 3см3 для 1 грамма воды.
В критическом состоянии переход вещества из жидкого состояния в газообразное и наоборот осуществляется беспрерывно. Вблизи критического состояния вещество в газообразном состоянии становится мутным, благодаря интенсивному рассеянию света на неоднородностях среды. Это явление называется критической опалесценцией. Вблизи критического состояния возникают флуктуации плотности газа. Точка К – точка перегиба кривой, касательная к кривой в этой точке горизонтальная (рис.4). Поэтому вблизи точки К dp/dV ≈ 0. Следовательно, вблизи критической точки значительные изменения плотности вещества (dV) вызывают незначительное изменение давления (dp). Поэтому флуктуации плотности могут быть значительными и приводить к возникновению мельчайших капелек жидкости, на которых и рассеивается свет.
Вдали от критического состояния dp/dV ≠ 0 и, поэтому изменения плотности приводят к значительному изменению давления, которое быстро выравнивается. Следовательно, вдали от критического состояния значительных флуктуаций плотности наблюдаться не будет.
Если соединить между собой крайние точки a и c горизонтальных участков семейства экспериментальных изотерм, то получится дугообразная кривая, которая разделяет pV диаграмму на три области (рис.6):
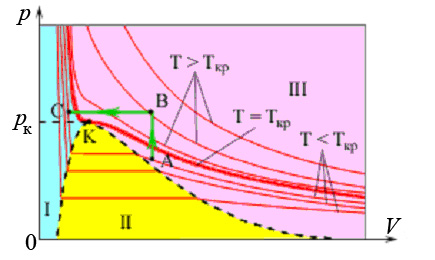
Рис.6. Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка.
Если вещество находится в области III при T > Tк, то никаким сжатием оно не может быть переведено в жидкое состояние.
Выбрав процесс перехода, чтобы он нигде не пересекал двухфазную область II, можно осуществить переход из жидкого состояния в газообразное (A → B → C) и наоборот (C → B → A) без разделения вещества на две фазы. В этом случае, в процессе перехода вещество все время будет оставаться однородным.
Лекция 17
Дата добавления: 2017-09-01; просмотров: 1841;











