ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Влияние изменения концентрации реагирующих
Веществ на химическое равновесие
Для опыта воспользуемся следующей реакцией:
FeCl3 + 3KCNS ® Fe(CNS)3 + 3KCl.
Из веществ этой реакции только роданид железа интенсивно окрашен в красный цвет. Поэтому изменение его концентрации сказывается на интенсивности окраски раствора. Это и позволяет наблюдать, в каком направлении смещается равновесие при изменении концентрации реагирующих веществ.
В четыре пробирки внести по 5 – 7 капель 0,0025 н раствора хлорида железа (Ш) и роданида калия. В первую пробирку добавить  одну каплю насыщенного раствора хлорида железа (Ш), во вторую – одну каплю насыщенного раствора роданида калия, в третью – несколько кристаллов хлорида калия. Четвертую пробирку оставить для сравнения.
одну каплю насыщенного раствора хлорида железа (Ш), во вторую – одну каплю насыщенного раствора роданида калия, в третью – несколько кристаллов хлорида калия. Четвертую пробирку оставить для сравнения.
Сопоставляя интенсивность окраски полученных растворов с цветом раствора четвертой пробирки и пользуясь выражением константы химического равновесия
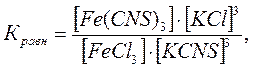
объяснить изменение окраски в первой, второй и третьей пробирках. Результаты опытов свести в таблицу 2.
Таблица 2
| № | Добавлен-ный раствор | Изменение интенсивно- сти окраски (усиление, ослабление | Направление смещения равновесия (вправо, влево) | Изменение концентрации компонентов (увеличение, уменьшение) | |||
| FeCl3 | KCNS | KCl | Fe(CNS)3 | ||||
| FeCl3 | |||||||
| KCNS | |||||||
| KCl |
Как можно обратимую реакцию довести практически до конца?
Опыт 2. Смещение химического равновесия в зависимости
От рН среды.
Заполнить наполовину две пробирки раствором бихромата калия К2Сr2O7, а две другие – хроматом калия К2СrO4. Указать цвет каждой из пробирок с этими растворами. Отличаются ли они?
В одну из пробирок с хроматом калия прилить 1-2 мл 2 н раствора гидроксида калия KOH. Вторая пробирка служит для сравнения. Изменилась ли окраска? О чем это свидетельствует? Написать в ионно-молекулярной и молекулярной форме уравнение реакции перехода бихромата в хромат.
В одну из пробирок с хроматом калия прилить 1-2 мл 2 н раствора серной кислоты H2SO4. Как изменяется цвет раствора? На что это указывает? Написать в ионно-молекулярной и молекулярной форме уравнение соответствующей реакции.
Опыт 3. Влияние изменения температуры на химическое
Равновесие.
А. В водном растворе аммиака существуют равновсия:
NH3 + H2O ® NH3 . H2O NH3 . H2O ® NH4+ + OH –
При повышении температуры равновесие этих реакций смещается влево (гидратация сопровождается выделением тепла).
В пробирку налить 3-4 мл воды, добавить 1 каплю 3 % - ного раствора аммиака и одну каплю раствора фенолфталеина. Нагреть пробирку на водяной бане. Наблюдать исчезновение красной окраски. Затем охладить пробирку водой из под крана – окрашивание появляется вновь. Объяснить наблюдаемое явление в соответствии с принципом Ле- Шателье.
Б. При взаимодействии иода с крахмалом образуется сложное вещество синего цвета - иодокрахмал. Равновесие ее можно представить условно схемой:
Иод + крахмал ® иодокрахмал, D H < 0.
В две пробирки налить по 2-3 мл крахмала и по 1-2 капли 0,1 н раствора иода до появления синей окраски. Одну из пробирок нагреть на водяной бане и наблюдать изменение окраски. Вторая пробирка служит для сравнения. Затем охладить нагретую пробирку водой из под крана – синее окрашивание появляется снова. Объяснить наблюдаемое явление, используя принцип Ле – Шателье.
В. Рассмотрим реакцию образования димера диоксида азота N2O4 из диоксида азота NO2, состояние равновесия которой зависит от температуры:
2NO2 ( г ) ® N2O4 ( г ), D Н реакции = - 61,4 кДж.
краснобурый бесцветный
Прибор, в котором изучается равновесие этой реакции, состоит из двух круглых, соединенных между собой небольших стеклянных баллонов, заполненных диоксидом азота.
Один из баллонов опустить в стакан с горячей водой, другой –
в стакан с ледяной водой (холодную и горячую воду приготовить заранее). Наблюдать изменение окраски в том и другом баллоне.
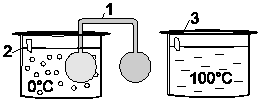
Рис. 2. Определение смещения равновесия химической реакции:
1 - сосуд с газовой смесью (NO2 + N2O4); 2 - стакан со льдом; 3 - стакан с кипящей водой
Вынуть баллоны из стаканов, а тот баллон, который был в холодной воде, опустить в горячую воду, а баллон из горячей воды – в холодную. Наблюдать вновь изменение окраски в каждом баллоне.
В каком направлении происходит смещение равновесия данной реакции при нагревании и охлаждении? Объяснить смещение равновесия, исходя из принципа Ле – Шателье.
Дата добавления: 2021-09-07; просмотров: 539;











