Запомнить. Гидролиз протекает по слабому электролиту, а среда определяется сильным электролитом.
Для многоосновных кислот гидролиз протекает ступенчато с образованием на первых ступенях гидролиза кислых солей, преимущественно по первой ступени.
2. Гидролиз соли, образованной сильной кислотой и слабым основанием:
NH4Cl + H2O  NH4OH + НCl
NH4OH + НCl
В результате гидролиза такой соли образуется слабое основание и сильная кислота. В растворе будет больше ионов водорода, чем гидроксоионов, и раствор приобретет кислую реакцию. 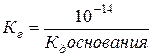
Гидролиз солей, образованных слабым основанием многовалентного металла, протекает ступенчато с образованием на первых ступенях гидролиза основных солей.
3. Гидролиз соли, образованной слабым основанием и слабой кислотой:
CH3COONH4 + H2O  CH3COOH + NH4OH
CH3COOH + NH4OH
Продукты гидролиза – слабая кислота и слабое основание. Реакция раствора близка к нейтральной.
В результате полного гидролиза соли образованные слабым основанием и слабой кислотой разлагаются в воде и не могут быть получены из водных растворов.
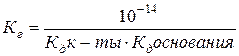
4. Соль образованная сильным основанием и сильной кислотой гидролизу не подвергается.
NaCl + H2O гидролиз не идет
Взаимный гидролиз
Гидролиз солей протекает по схемам:
FeCl3 Fe+3 + HOH 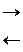 FeOH+2 + H+
FeOH+2 + H+
Na2CO3 CO3-2 + HOH 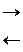 HCO3– + OH–
HCO3– + OH–
При сливании солей они нейтрализуются.
2FeCl3 + 3Na2CO3 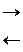 6NaCl + Fe2(CO3)3
6NaCl + Fe2(CO3)3
В водном растворе хлорид натрия гидролизу не подвергается, гидролиз карбоната железа протекает в одну ступень, гидролиз усиливается, за счет выпадения осадка и выделения газа.
Fe2(CO3)3 + 6H2O ® 2Fe(OH)3¯ + 3H2O + 3CO2
Получаем:
2FeCl3 + 3Na2CO3 + 3H2O 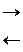 6NaCl + 2Fe(OH)3¯ + 3H2O + 3CO2
6NaCl + 2Fe(OH)3¯ + 3H2O + 3CO2
Для большинства солей процесс гидролиза обратим.
Количественно процесс гидролиза солей можно охарактеризовать степенью гидролиза (h), показывающей отношение числа гидролизованных молекул к общему числу растворенных молекул (выражаемое обычно в %).
Дата добавления: 2020-10-14; просмотров: 608;











