ВЛИЯНИЕ КОНЦЕНТРАЦИИ РЕАГИРУЮЩИХ ВЕЩЕСТВ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Влияние концентрации на скорость химической реакции выражается законом действующих масс: «При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам». Закон справедлив только для элементарных реакций.
В общем виде для реакции аА+ bB = cC аналитическое выражение закона действующих масс будет иметь вид
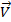 =
= 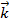 [A]a[B]b, где a и b – порядки реакции по каждому реагенту, соответствующие стехиометрическим коэффи-циентам.
[A]a[B]b, где a и b – порядки реакции по каждому реагенту, соответствующие стехиометрическим коэффи-циентам.
Для конкретной реакции I2(г) + H2(г) ⇄ 2HI(г) уравнение скорости прямой реакции будет 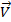 =
= 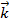 [I2][H2], а обратной реакции
[I2][H2], а обратной реакции 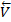 =
= 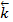 [HI]2. В этих уравнениях
[HI]2. В этих уравнениях 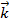 и
и 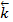 – константы скорости прямой и обратной реакций. Константа скорости – это скорость реакции при концентрации реагирующих веществ, равных единице. Таким образом, константу скорости можно рассматривать как удельную скорость.
– константы скорости прямой и обратной реакций. Константа скорости – это скорость реакции при концентрации реагирующих веществ, равных единице. Таким образом, константу скорости можно рассматривать как удельную скорость.
В случае гетерогенных процессов, когда реакция протекает на границе раздела фаз, в уравнение скорости
входят концентрации только газообразных или растворенных веществ. Концентрация твердого вещества в процессе реакции остается постоянной и в уравнение скорости реакции не включается.
Например, для гетерогенной реакции Si(тв) + O2(г) = SiO2(тв) уравнение скорости прямой реакции будет 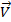 =
= 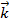 [O2].
[O2].
Дата добавления: 2021-09-07; просмотров: 411;











