НА СОСТОЯНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
После изменения внешних условий состояние химического равновесия нарушается, так как скорости прямой и обратной реакций в разной степени зависят от этих изменений. Происходит сдвиг равновесия в сторону прямой (вправо) или обратной (влево) реакции, после чего в системе установится новое состояние равновесия, при котором равновесные концентрации реагентов будут отличны от предыдущих.
В качественной форме направление смещения равновесия, можно определить, пользуясь принципом Ле Шателье: «Если на систему (реакцию), находящуюся в состоянии равновесия оказать какое-либо внешнее воздействие, то равновесие сместится в том направлении, при котором это воздействие уменьшается». Иными словами равновесная система стремится сохранить старое состояние равновесия и противодействует внешнему воздействию.
К наиболее очевидным факторам, способным повлиять на состояние химического равновесия, относятся температура и концентрация реагентов. Для реакций, протекающих с участием газов при постоянной температуре, дополнительным фактором является давление, т.к. его изменение приводит к изменению объема и, следовательно, к изменению концентрации газовых реагентов, причем в разной степени для исходных веществ и продуктов реакции. Рассмотрим влияние этих факторов на смещение равновесия в системе:
N2(г) + 3H2(г) ⇄ 2NH3(г) , DНх.р< 0 (I)
1. Влияние давления
При повышении давления равновесие в системе смещается в сторону меньшего количества молей газообразных веществ. В данной системе произойдет смещение равновесия вправо, т.е. в сторону прямой реакции.
И наоборот, при уменьшении давления равновесие в системе смещается в сторону большего количества молей газообразных веществ. В данной системе произойдет смещение равновесия влево, т.е. в сторону обратной реакции.
При изменении давления в системе не произойдет смещения равновесия, если количество моль газообразных веществ в ходе реакции не изменяется.
2. Влияние концентрации реагентов
Изменение концентрации одного или нескольких реагентов в равновесной смеси приведет к смещению равновесия, причем увеличение концентрации исходных веществ сдвигает равновесие вправо, что увеличивает выход продуктов. К такому же эффекту приводит отвод продуктов из равновесной смеси (например, сжижение аммиака и откачка его из реактора). Увеличение концентрации продуктов реакции или уменьшение концентрации исходных веществ вызывает смещение равновесия влево, т.е. в сторону исходных веществ.
3. Влияние температуры
По отношению к обратимым химическим процессам повышение температуры вызывает сдвиг равновесия в сторону реакции, протекающей с поглощением тепла (эндотерми-ческой реакции), понижение температуры – в сторону реакции, протекающей с выделением тепла (экзотермической реакции).
Константа равновесия реакции связана со стандартным изменением свободной энергии Гиббса соотношением
DG0х.р = - RT lnKp, а DG0х.р = DН0х.р - ТDS0х.р. Тогда lnKp = 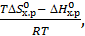 lnKp =
lnKp = 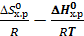 .
.
Для реакции (I), протекающей с выделением тепла (DНх.р<0), увеличение температуры приведет к уменьшению Кр. Это значит, что количество продуктов реакции уменьшится, а количество исходных веществ увеличится, т.е. равновесие сместится влево, так как обратная реакция протекает с поглощением тепла. И наоборот, для реакции, протекающей с поглощением тепла (DНх.р > 0), при увеличении температуры Кр увеличится, т.е. равновесие сместится вправо (в сторону эндотермической реакции).
Таким образом, при увеличении температуры константа равновесия эндотермической реакции (DНх.р > 0) увеличивается, а зкзотермической реакции (DНх.р < 0) – уменьшается.
Дата добавления: 2021-09-07; просмотров: 451;











