Теоретические основы восстановительного обжига
Целью восстановительного обжига является перевод окислов металлов, содержащихся в рудах и концентратах в металлическое состояние или в низшие окислы. Известно, что восстановительные процессы находят широкое распространение в металлургии, где они имеют самостоятельное значение, как способы получения готовых металлов из их окислов. Эти процессы детально рассмотрены в обширной литературе по металлургии и нами здесь не затронуты. Мы ограничимся лишь восстановительным обжигом различных рудных материалов, как подготовительной операцией к их обогащению и металлургическому переделу. Примерами таких операций является магнетизирующий обжиг окисленных железных руд с целью перевода оксидов Fe в сильномагнитные (преимущественно магнетит) с последующей их концентрацией на магнитных сепараторах. Магнетизирующий обжиг также находит применение для подготовки к обогащению никель - содержащих латеритовых, титанциркон - содержащих руд, для обезжелезнения высокожелезистых бокситов и в других процессах.
Восстановительным процессом получают также металлические продукты из высокочистых концентратов, которые являются исходными материалами для производства железных, никелевых, медных и других металлических порошков.
Аналогичным процессом, но с восстановлением не до магнетита, а до металла; является металлизирующий обжиг железных руд. Металлизирующий обжиг руд является способом глубокой физико - химической, подготовки руд позволяющим перенести значительную часть восстановительного процесса из плавильного передела в рудоподготовительный. В ряде случаев это позволяет в металлургическом производстве получить значительный технико - экономический эффект. Для бедных труднообогатимых железных руд иногда металлизирующий обжиг является подготовительной операцией перед обогащением. Обожженный продукт с включенными в нем частицами металлического Fe после измельчения до соответствующей крупности, обеспечивающего их раскрытие, подвергают магнитной сепарации. Полученные концентраты Fe используют в качестве металлошихты в доменных или сталеплавильных печах. Аналогичный процесс металлизирующего обжига применим также к окисленным рудам цветных металлов, например, к окисленным медным рудам для интенсификации их флотационного обогащения, так как металлическая Сu обладает более высокой флотируемостью, чем окисленные медные минералы. Применяют восстановительный; обжиг никельсодержащих латеритовых и серпентинитовых, оловянных и других руд цветных металлов.
В технологии переработки бедных окисленных руд цветных металлов применяют также восстановительно - сульфидирующий обжиг. При этом металлы из оксидной формы переводятся в сульфидную, что позволяет интенсифицировать процесс их флотационного обогащения. Восстановительный обжиг обычно осуществляют с применением газообразных, твердых или жидких восстановителей.
Процесс восстановления газом оксидов нелетучих элементов в термодинамическом аспекте можно рассматривать, как совмещение процесса диссоциации оксида и взаимодействия газообразного восстановителя с O2, Такое представление не связано с механизмом процесса и является лишь формальным приемом:
2MeO = 2Me + O2 + H1 (34)
2H2 + O2 = 2H2O - H2 или (2CO + O2 = 2CO3 - H3) (35)
2MeO + 2H2 (CO) = 2Me + 2H2O(CO2) + H (36)
Константы равновесия для трех реакций могут быть записаны следующим образом :
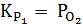 ;
; 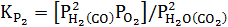 ;
; 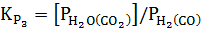 ; (37)
; (37)
Откуда константу равновесия реакции газового восстановления оксида можно выразить:
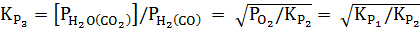 ; (38)
; (38)
Восстановление оксидов летучих металлов, например, Zn протекает следующим образом: ZnOT + СО(Н2) = Zn(г) + СO2 (Н2O). Константа равновесия данной реакции: KP = PZn · 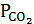 /PCO или KP = PZn ·
/PCO или KP = PZn · 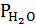 /
/ 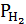
Более подробно термодинамику восстановления рассмотрим на примере оксидов Fe как наиболее изученную. Процесс восстановления развивается ступенчато и зонально. Впервые представление о зональности процесса было сформулировано А.А. Байковым в виде принципа последовательности превращений, состоящего в том, что высший оксид при взаимодействии с восстановителем переходит в низший и в конечном итоге - в металл. Так, восстановление оксидов железа может протекать по двум схемам:
Fe2O3 → Fe3O4 → FeO → Fe (для Т> 845 К);
Fe2O3 → Fe3O4 → Fe (для Т< 845 К).
При этом, как следует из диаграммы Fe - О, в системе могут возникать не толькооксиды и металл, но и твердые растворы.
При восстановлении газом оксидов Fe могут иметь место следующие реакции:
3Fe2O3 + CO = 2Fe3O4 + СO2 - 37,25МДж; (39)
Fe3O4 + СО = 3 FeO + СO2 + 20,96МДж; (40)
FeO + СО = Fe + СO2- 13,65 МДж; (41)
3Fe2O3 + Н2 = 2Fe3O4 + Н2O + 4,2 МДж; (42)
Fe3O4 + Н2 = 3FeO + Н2О + 62,41 МДж; (43)
FeO + Н2 = Fe + Н2О + 27,80 МДж. (44)
По данным из работы для реакций (39) и (42) константы равновесия соответственно равны: lg КP = 1720/T + 2,81; lg КP = - 160/T + 4,48. Они характеризуются весьма Малыми содержаниями восстановителя в равновесной газовой фазе и практически являются необратимыми, т.е. образующийся магнитный оксид устойчив в атмосфере диоксида С и водяного пара. Для реакций. (40) и (43): lg Кр = - 1560/T + 2,0; lg KP= - 3440/T + 3,67, т.к. реакции идут с поглощением тепла, константы равновесия их растут с повышением температуры, т.е содержание СО и Н2 в равновесной смеси падает. Реакция (41) сопровождается выделением тепла; поэтому с ростом температуры равновесие сдвигается влево. Для нее lg Кр = 1190/T - 1,26. Реакция (44) эндотермична, поэтому равновесие с ростом температуры сдвигается вправо. Для этой реакции lg Кр - 690/T + 0,405. Суммарный тепловой эффект восстановления оксидов Fe по реакциям (39) - (41) слабо экзотермичен (около 230 кДж/кг Fe), а по реакциям (42) - (44) - эндотермичен (около 880 кДж/кг). Небольшие затраты тепла или даже его выделения при восстановлении обусловлены большим экзотермическим эффектом окисления восстановителей - оксида С и Н.
При температурах ниже 845 К термодинамическое восстановление должно протекать без образования вюстита:
Fe3O4 + 4СО = 3Fe + 4СO2 - 20 МДж; (45)
Fe3O4 + 4Н2 = 3Fe + 4Н2O + 145,81 МДж. (46)
Так как реакция (45) сопровождается выделением, а (46) поглощением тепла, то с повышением температуры равновесие по реакции (45) сдвигается влево, а по (46) - вправо.
Графическое изображение условий равновесия реакций восстановления, оксидов Fe приведено на рисунке 34.
При восстановлении оксидов в присутствии твердого С процесс условно можно рассматривать, как двухстадийный:
МеО + СО = Ме + СO2 (47)
СO2 + С = 2СО (48)
МеО + С = Ме + СО (49)
Константы равновесия реакции восстановления оксида и газификации С, а также зависимость общего давления от парциальных давлений компонентов газовой смеси выражаются формулами: K1 = 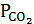 /PCO = f (Т); K2 =
/PCO = f (Т); K2 = 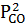 /
/ 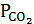 = f (T) и PCO +
= f (T) и PCO + 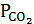 = P. Совместное решение этих уравнений позволяет определить все три неизвестные величины (PCO,
= P. Совместное решение этих уравнений позволяет определить все три неизвестные величины (PCO, 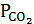 и Р) для заданных температур.
и Р) для заданных температур.
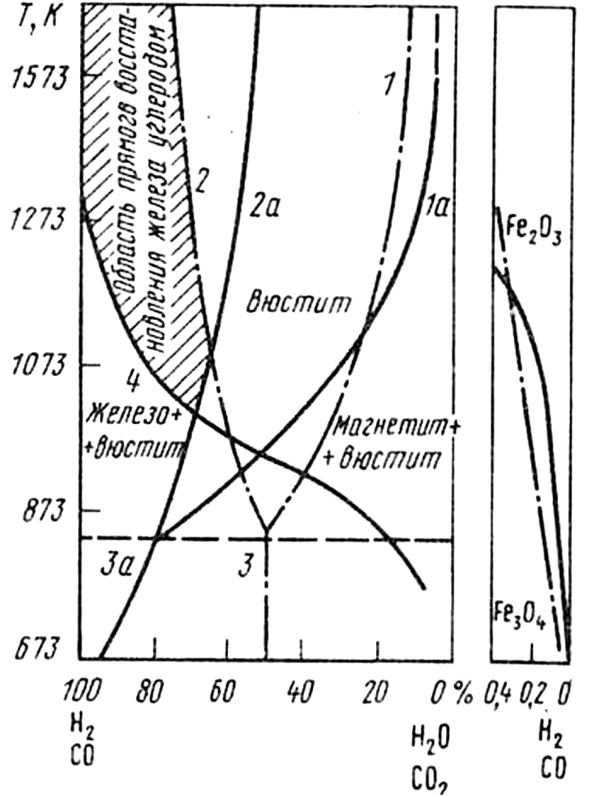
Условия равновесия для реакций: 1 - Fe3O4 + СО = 3 FeO + СO2; 2 - FeO + СО = Fe + СO2; 3 - Fe3O4 + 4СО = 3Fe + 4СO2; 4 - CO2 + C = 2CO; 1a - Fe3O4 + Н2 = 3FeO + Н2О; 2в - FeO + Н2 = Fe + Н2О; 3a - Fe3O4 + 4Н2 = 3Fe + 4Н2O
Рисунок 34. Диаграмма состояния систем Fe - О - С и Fe - О - Н.
При восстановлении оксидов Fe твердым С возможны следующие реакции:
3Fe2O3 + С = 2Fe3O4 + СО + 003129,07 МДж; Fe3O4 + С = 3FeO + СО + 137,28 МДж ; FeO + С = Fe + СО + 152,67 МДж. В реальных условиях контакт твердых фаз оксидов Fe и С ограничен, процессы восстановления с твердым С также следует рассматривать с учетом их протекания через газовую фазу по ранее приведенным реакциями (1) и (6).. При этом образование газов восстановителей происходит по реакциям: СO2 + С = 2СО; Н2O + С = Н2 + СО. Реакция газификации С его диоксидом (реакция Белла - Будуара) зависит от давления и является обратимой.
С учетом тепловых эффектов реакций в соответствии с принципом Ле - Шателье реакция распада оксида С более вероятна при низких температурах, его образования - при высоких. Принято называть реакцию прямым восстановлением, если в ходе ее в присутствии твердого С газообразным продуктом является СО или непрямым (косвенным), если при восстановлении образуется СO2 и Н2O.
Механизм твердофазного восстановления окислов металлов согласно современной адсорбционно - автокаталитической теории, развиваемой Г.И. Чуфаровым, состоит из адсорбции газа - восстановителя (Вадс) реакционной поверхностью, отрыва от оксида и соединение его с адсорбированным газом - восстановителем (Вадс). Схематично этот процесс может быть представлен следующим образом: МеОтв + Вг = МеОтвВадс; МеОтвВадс = МетвВОадс; МетвВОадс=: Метв + ВОг. Восстановление, например, оксидов Fe* происходит поэтапно с образованием промежуточных твердых растворов O2 в новых фазах и последующим обеднением этих фаз кислородом:
1 этап Fe2O3 + СО = Fe2O3 min + СO2;
2 этап 3Fe2O3 min + СО = 2Fe3O4 max + СO2;
3 этап Fe3O4 max + СО = Fe3O4 min + СO2;
4 этап Fe3O4 min + СО = 3FeO max + СO2;
5 этап FeO max + СО = FeO min + СO2;
6 этап FeO min + СО = (Feтет) max О + CO2;
7 этап (FeMex) max О + CO = (Feмет) min О + CO2
При этом четные этапы, наряду с отнятием O2, характеризуют также кристаллохимические превращения. Косвенным доказательством образования промежуточных фаз между гематитом и магнетитом могут служить исследования Э.П. Сальдау, дополненные И.В. Михеевой. По их данным в ряду оксидов γ - Fe2O3 - Fe3O4, полученных в результате окисления иоцита, параметр элементарной решетки непрерывно возрастает по мере роста доли Fe2+ в железокислородном соединении от 0,83 м для γ - Fe2O3, до 0,84 для магнетита Fe3O4. Промежуточные соединения названы ими окси - магметитами. Здесь, однако, необходимо отметить, что указанному авторами на диаграмме маггемиту отводится некоторая область с содержанием в Нем доли ионов двухвалентного Fe от общего его содержания в магнетите до 0,25. С этим нельзя согласиться, так как главным кристаллохимическим отличием маггемита, как и гематита, от других оксидов Fe, является отсутствие в его кристаллической решетке ионов двухвалентного Fe. По - видимому, все оксиды Fe кристаллической решетке которых в той или иной степени имеет место сочетание ионов двух и трехвалентного Fe должны быть отнесены к оксимагнетитам, а при их соотношении 1:2 - к магнетиту.
Дата добавления: 2017-06-13; просмотров: 3454;











