XIV. ОСНОВЫ МАССОПЕРЕДАЧИ
1. Общие сведения
2. Абсорбция
2.1. Общие сведения
2.2. Материальный баланс процесса
2.3. Устройство абсорбционных аппаратов
3. Десорбция
4. Схемы абсорбционных установок
Общие сведения
В химической технологии широко распространены и имеют важное значение процессы массопередачи, характеризуемые переходом одного или нескольких веществ из одной фазы в другую. Путем переноса одного или более компонентов из фазы в фазу можно разделять как гетерогенные, так и гомогенные системы (разовые смеси, растворы жидкостей и др.), причем наиболее часто процессы массопередачи используют для разделения гомогенных систем.
Виды процессов массопередачи. В промышленности применяются в основном следующие процессы массопередачи:
- между газовой (паровой) и жидкой;
- между газовой и твердой;
- между твердой и жидкой;
- между двумя жидкими фазами.
Абсорбция — поглощение газа жидкостью, т.е. процесс разделения, характеризуемый переходом вещества из газовой фазы в жидкую. Обратный процесс выделения газа из жидкости называется десорбцией.
Экстракция (в системе жидкость-жидкость) – извлечение вещества, растворенного в жидкости, другой жидкостью, практически не смешивающейся или частично смешивающейся с первой. При этом извлекаемый компонент исходного раствора переходит из одной жидкой фазы в другую.
Перегонка — разделение гомогенных жидких смесей путем взаимного обмена компонентами между жидкостью и паром, полученным испарением разделяемой жидкой смеси.
Адсорбция — поглощение компонента газа, пара или раствора твердым пористым поглотителем, т.е. процесс разделения, характеризуемый переходом вещества из газовой (паровой) или жидкой фазы в твердую. Обратный процесс — десорбция — проводится после адсорбции и часто используется для регенерации поглощенного вещества из поглотителя.
Разновидностью адсорбции является ионный обмен — процесс разделения, основанный на способности некоторых твердых веществ (ионитов) обменивать свои подвижные ионы на ионы растворов электролитов.
Сушка — удаление влаги из твердых материалов, главным образом путем ее испарения. В этом процессе влага переходит из твердой фазы в газовую или паровую.
Кристаллизация — выделение твердой фазы в виде кристаллов из растворов или расплавов. Кристаллизация осуществляется в результате пересыщения или переохлаждения раствора (расплава) и характеризуется переходом вещества из жидкой фазы в твердую.
Растворение и экстракция (в системе твердое тело—жидкость). Растворение характеризуется переходом твердой фазы в жидкую (растворитель) и представляет собой, таким образом, процесс, обратный кристаллизации. Извлечение на основе избирательной растворимости одного или нескольких компонентов из твердого пористого материала, называется экстракцией из твердого или выщелачиванием.
Подобно теплопередаче массопередача представляет собой сложный процесс, включающий перенос вещества (массы) в пределах одной фазы, перенос через поверхность раздела фаз и его перенос в пределах другой фазы. Как известно, при теплопередаче обменивающиеся теплом среды в большинстве случаев разделены твердой стенкой, в то время как массопередача происходит обычно через границу раздела соприкасающихся фаз. Эта граница может быть либо подвижной (массопередача в системах газ—жидкость или пар—жидкость, жидкость—жидкость), либо неподвижной (массопередача с твердой фазой).
Перенос вещества из фазы к границе раздела фаз или в обратном направлении, т.е. в пределах одной из фаз, называется массоотдачей.
Процессы массопередачи можно разделить на две группы. К одной группе относятся процессы (абсорбция, экстракция и др.) в которых участвуют минимально три вещества: одно находится только в одной фазе, другое — только во второй фазе, а третье — переходит из одной фазы в другую и представляет собой распределяемое между фазами вещество. Первое и второе вещества являются лишь носителями распределяемого вещества и сами не переходят из фазы в фазу. Так, например, при поглощении аммиака водой из его смеси с воздухом, вода и воздух служат носителями распределяемого вещества — аммиака.
К другой группе относятся процессы (например, перегонка), в которых вещества, составляющие две фазы, обмениваясь компонентами, сами непосредственно участвуют в массопередаче и уже не могут рассматриваться как инертные носители распределяемого вещества.
Скорость массообменных процессов, как правило, лимитируется молекулярной диффузией. Поэтому процессы массопередачи иногда называют диффузионными процессами.
Для массообменных процессов, по аналогии с процессами переноса тепла, принимают, что количество переносимого вещества пропорционально поверхности раздела фаз и движущей силе. Движущая сила характеризуется степенью отклонения системы от состояния динамического равновесия, выражаемой наиболее точно разностью химических потенциалов распределяемого вещества. Диффундирующее в пределах фазы вещество перемещается от точки с большей к точке с меньшей концентрацией, и в расчетах движущую силу процессов массопереноса выражают приближенно через разность концентраций подобно тому, как в процессах теплопереноса ее выражают разностью температур. Расчетные выражения движущей силы не одинаковы для процессов массоотдачи и массопередачи и будут рассмотрены ниже для каждого из этих процессов.
Процессы массопередачи избирательны в тех случаях, когда поглотитель извлекает только один компонент (или несколько компонентов) исходной смеси и практически не извлекает остальные ее компоненты. Эти процессы большей частью обратимы, т.е. могут протекать в противоположных направлениях в зависимости от температуры, давления и других условий их проведения. При этом направление перехода вещества из фазы в фазу определяется концентрациями распределяемого вещества в фазах и условиями равновесия.
Способы выражения состава фаз. Обычно количественный состав фаз выражают:
1) в объемных концентрациях, принимая за единицу массы 1 кг или за единицу количества вещества 1 моль; объемная концентрация представляет собой число килограммов (или киломолей) данного компонента, приходящееся на единицу объема фазы (в кг/м3 или кмоль/м3);
2) в весовых или мольных долях, представляющих собой отношение массы (или количества) данного компонента к массе (или количеству) всей фазы;
3) в относительных концентрациях, т.е. в виде отношения массы (или количества) данного компонента, являющегося распределяемым веществом, к массе (или количеству) компонента-носителя, количество которого остается постоянным в процессе массопередачи.
Материальный баланс. Рабочая линия. Рабочие концентрации распределяемого вещества не равны равновесным, и в действующих аппаратах никогда не достигают равновесных значений.
Зависимость между рабочими концентрациями распределяемого вещества в фазах у = f (x) изображается линией, которая носит название рабочей линии процесса. Вид функции у — f (x), или уравнение рабочей линии в его общем виде, является одинаковым для всех массообменных процессов и получается из их материальных балансов.
Рассмотрим схему массообменного аппарата, работающего в режиме идеального вытеснения при противотоке фаз (рис. Х-2). Пусть М процесс массопередачи из фазы в фазу, например из газовой фазы в жидкую, переходит только один распределяемый компонент (скажем, аммиак).
Сверху в аппарат поступает LH кг/сек одной фазы (жидкой), содержащей 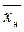 вес. долей распределяемого компонента, а снизу из аппарата удаляется Lk кг/сек той же фазы, содержащей
вес. долей распределяемого компонента, а снизу из аппарата удаляется Lk кг/сек той же фазы, содержащей 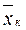 вес. долей распределяемого компонента. Снизу в аппарат поступает Gh кг/сек другой фазы (газовой) концентрацией
вес. долей распределяемого компонента. Снизу в аппарат поступает Gh кг/сек другой фазы (газовой) концентрацией 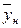 и сверху удаляется Gk кг/сек этой фазы, имеющей концентрацию
и сверху удаляется Gk кг/сек этой фазы, имеющей концентрацию 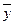 к вес. долей распределяемого компонента.
к вес. долей распределяемого компонента.
Тогда материальный баланс по всему веществу
Gн + Lн = Gк + Lк
и материальный баланс по распределяемому компоненту
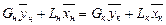
Теперь напишем уравнения материального баланса для части аппарата от его нижнего конца до некоторого произвольного сечения, для которого расходы фаз составляют G и L кг/сек, а их текущие концентрации равны 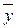 и
и 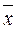 соответственно.
соответственно.
Материальный баланс по всему веществу
Gн + L = G + Lк
и материальный баланс по распределяемому компоненту
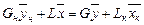
Решая это уравнение относительно 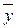 , получим
, получим
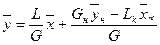 (XIV,1)
(XIV,1)
Уравнение (XIV,1) представляет собой уравнение рабочей линии, выражающее связь между рабочими концентрациями распределяемого компонента в фазах для произвольного сечения аппарата.
Расходы фаз постоянны по высоте аппарата, например, в процессах ректификации, когда числа молей компонентов, которыми обмениваются фазы, равны. В других случаях, если концентрации фаз мало изменяются по высоте аппарата, то расходы фаз по его высоте можно с достаточной для практических целей точностью считать постоянными, т.е. принять L = const и G = const. При этом Lк = L, Gн = G и уравнение (Х,1) приводится к виду
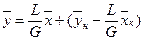 (XIV.1a)
(XIV.1a)
Вводя обозначения 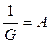 и
и 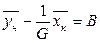 , находим
, находим
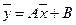 (XIV.1б)
(XIV.1б)
Выражения (XIV,1а) и (XIV,1б) являются уравнениями рабочей линии, которыми обычно пользуются при расчетах массообменных процессов.
Таким образом, рабочая линия представляет собой прямую, которая наклонена к горизонту под углом, тангенс которого равен А, и отсекает на оси ординат отрезок, равный В. Рабочая линия для всего аппарата ограничена точками с координатами 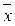 н и
н и 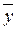 к (верхний конец аппарата, рис. XIV-2) и
к (верхний конец аппарата, рис. XIV-2) и 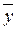 и и
и и 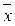 к (нижний конец аппарата).
к (нижний конец аппарата).
АБСОРБЦИЯ
Общие сведения
Абсорбцией называют процесс поглощения газов или паров из газовых или парогазовых смесей жидкими поглотителями (абсорбентами).
При физической абсорбции поглощаемый газ (абсорбтив) не взаимодействует химически с абсорбентом. Если же абсорбтив образует с абсорбентом химическое соединение, то процесс называется хемосорбцией.
Физическая абсорбция в большинстве случаев обратима. На этом свойстве абсорбционных процессов основано выделение поглощенного газа из раствора — десорбция.
Сочетание абсорбции с десорбцией позволяет многократно применять поглотитель и выделять поглощенный компонент в чистом виде. Во многих случаях проводить десорбцию не обязательно, так как абсорбент и абсорбтив представляют собой дешевые или отбросные продукты, которые после абсорбции можно вновь не использовать (например, при очистке газов).
В промышленности процессы абсорбции применяются главным образом для извлечения ценных компонентов из газовых смесей или для очистки этих смесей от вредных примесей.
Абсорбционные процессы широко распространены в химической технологии и являются основной технологической стадией ряда важнейших производств (например, абсорбция SO3 в производстве серной кислоты; абсорбция НС1 с получением соляной кислоты; абсорбция окислов азота водой в производстве азотной кислоты; абсорбция NH3, паров С6Н6, H2S и других компонентов из коксового газа; абсорбция паров различных углеводородов из газов переработки нефти и т.п.). Кроме того, абсорбционные процессы являются основными процессами при санитарной очистке выпускаемых в атмосферу отходящих газов от вредных примесей (например, очистка топочных газов от SO2; очистка от фтористых соединений газов, выделяющихся в производстве минеральных удобрений, и т.д.).
Дата добавления: 2016-10-18; просмотров: 6341;











